
(17分)降低太气中CO2含量及有效开发利用CO2,是科学家研究的重要课题。
(1)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
CH3OCH3(g)+3H2O(g) △H=-122.4kJ·mol-1
①某温度下,将2.0molCO2(g)和6.0molH2(g)充入体积可变的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化如下表所示。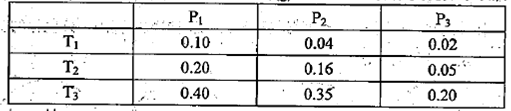
则Pl P3(填“>”“<”或“=”,下同)。若T1、Pl,T3、P3时平衡常数分别为K1、K3,
则K1 K3。T1、Pl时H2的平衡转化率为 。
②一定条件下,t上述反应在密闭容器中达平衡。当仅改变影响反应的一个条件,引起的下列变化能说明平衡一定向正反应方向移动的是____ 。
A.反应物的浓度降低 B.容器内压强增大
C.正反应速率大于逆反应速率 D.化学平衡常数K增大
(2)碳酸氢钾溶液加水稀释,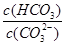 (填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
(填“增大”“不变”或“减小”)。用碳酸钾溶液吸收空气中CO2,当溶渡呈中性时,下列关系或说法正确的是 。
A.c(K+)=2c(CO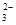 )+c(HCO
)+c(HCO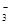 )+c(H2CO3)
)+c(H2CO3)
b.c(HCO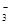 )
) c(CO
c(CO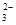 )
)
c.降低温度,c(H+)·c(OH-)不变
(3)向盛有FeCl3溶液的试管中滴加少量碳酸钾溶液,立即产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,反应的离子方程式为 。
(17分)
(1)① > (2分) < (2分)57.14%(2分)② c d(2分)
(2)减小(3分) b(3分)
(3)2Fe3++3CO32?+3H2O=2Fe(OH)3(胶体)+3CO2↑(3分)
解析试题分析:(1)①相同温度下,P1时CH3OCH3物质的量分数大于P3时CH3OCH3物质的量分数,根据化学方程式,加压平衡向右移动,所以P1 >P3;T3时CH3OCH3物质的量分数大于T1时CH3OCH3物质的量分数,因为该反应为放热反应,升高温度,平衡向逆反应方向移动,所以K1<K3;根据“三段式”进行计算,设生成的CH3OCH3的物质的量为x,则
2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
起始物质的量(mol) 2 6 0 0
转化物质的量(mol) 2x 6x x 3x
平衡物质的量(mol) 2— 2x 6—6x x 3x
则x/(8-4x)=0.1,解得x=0.5714,H2的平衡转化率=6x/6×100% =57.14%
②a、生成物的浓度也可能降低,如增大体积,平衡向逆反应方向移动,错误;b、如果加入惰性气体使容器内压强增大,平衡不移动,错误;c、正反应速率大于逆反应速率,平衡一定向正反应方向移动,正确;d、化学平衡常数K增大,说明平衡一定向正反应方向移动,正确。
(2)碳酸氢钾溶液加水稀释,HCO3?的电离平衡向右移动,所以c(HCO3?)/c(CO32?)减小;因为K2CO3和KHCO3溶液呈碱性,所以当溶渡呈中性时,CO2过量,溶液的溶质为KHCO3和H2CO3,故b项正确,根据电荷守恒可得c(K+)=2c(CO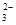 )+c(HCO
)+c(HCO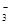 ),故a项错误,降低温度,水的电离平衡向左移动,c(H+)·c(OH-)减小,c项错误。
),故a项错误,降低温度,水的电离平衡向左移动,c(H+)·c(OH-)减小,c项错误。
(3)产生气体,溶液颜色加深,用激光笔照射能产生丁达尔效应,说明生成了CO2气体和Fe(OH)3胶体,所以离子方程式为:2Fe3++3CO32?+3H2O=2Fe(OH)3(胶体)+3CO2↑。
考点:本题考查化学平衡移动、电离平衡、离子浓度比较、离子方程式的书写、化学计算。


科目:高中化学 来源: 题型:填空题
(17分)研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)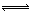 NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
NaNO3(s)+ClNO(g) K1 ?H < 0 (I)
2NO(g)+Cl2(g)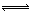 2ClNO(g) K2 ?H < 0 (II)
2ClNO(g) K2 ?H < 0 (II)
(1)4NO2(g)+2NaCl(s)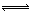 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol?L-1?min-1,则平衡后n(Cl2)= mol,NO的转化率а1= 。其它条件保持不变,反应(II)在恒压条件下进行,平衡时NO的转化率а2 а1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”或“不变”。若要使K2减小,可采用的措施是 。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol?L?1的CH3COONa溶液,则两溶液中c(NO3?)、c(NO2-)和c(CH3COO?)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol?L?1,CH3COOH的电离常数K a=1.7×10-5mol?L?1,可使溶液A和溶液B的pH相等的方法是 。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)
含硫化合物在工业生产中有广泛的用途。
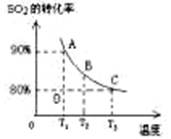
(1)对于可逆反应2SO2(g)+O2(g)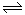 2SO3(g) △H<0,下列研究目的和图示相符的是
2SO3(g) △H<0,下列研究目的和图示相符的是
(填序号)
| 序号 | A | B | C | D |
| 目的 | 压强对平衡的影响 | 温度对转化率的影响 | 增加O2浓度对速率的影响 | 浓度对平衡常数的影响 |
| 图示 | 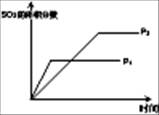 |  | 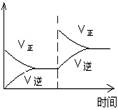 | 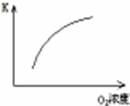 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)将6molA气体和2molB气体在2L密闭容器中混合并在一定条件下发生反应:3A(g)+B(g) xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
xC(g)+2D(g)。若经5min后反应达到平衡状态,容器内的压强变小,并知D的平均反应速率为0.2mol/(L?min),请填写下列空白:
①x的数值为 ; ②A的平均反应速率为 ; ③5min时B的转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)含铬污水处理是污染治理的重要课题。污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是: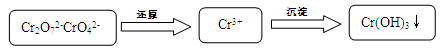
(1)加酸可以使CrO42-转化为Cr2O72-: 2CrO42- + 2H+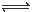 Cr2O72- + H2O
Cr2O72- + H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1 mol?L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K= 。
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为 。而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3] =10-32,要使c(Cr3+)降低到10-5mol?L-1,溶液的pH应升高到 。
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的 极。
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液。Cr(OH)3溶于稀硫酸的化学方程式为 。往100.00mL 0.1000 mol?L-1CrCl3溶液滴加1.000mol?L-1NaOH溶液, 请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图: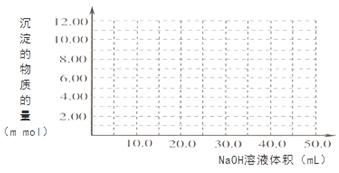
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g)  CO(g)+H2(g) ΔH=+131.3 kJ·mol-1一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母,下同)
A.容器中的压强不变
B.1 mol H—H键断裂的同时断裂2 mol H—O键
C.v正(CO)=v逆(H2O)
D.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)  CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
| 实 验 组 | 温 度 /℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
 CH3OH(g) +H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2, 下列措施中能使 c(CH3OH)增大的是
CH3OH(g) +H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2, 下列措施中能使 c(CH3OH)增大的是 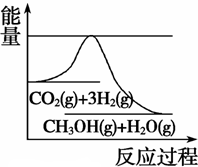
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
t ℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:3A(g)+B(g) xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________;平衡常数K=________。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡________(填写字母序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t ℃时达到新的平衡,此时B的物质的量为n(B)=________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com