
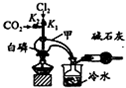
 三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.
三氯化磷(PCl3)是合成药物的重要化工原料,可通过白磷和氯气化合得到.| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 |
| 白磷 | 44.1 | 280.5 | 1.82 |
| PCl3 | -112 | 75.5 | 1.574 |
| POCl3 | 2 | 105.3 | 1.675 |
分析 (1)实验室制取氯气用浓盐酸与MnO2 在加热的条件下进行,装置采用固体和液体加热制取气体的装置,所以实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有圆底烧瓶和分液漏斗;水和硫酸铜反应生成蓝色的硫酸铜,可以使用硫酸铜粉末检验干燥的氯气没有漂白性,潮湿的氯气具有漂白性,可以使用干燥有色布条褪色检验;
(2)PCl3遇O2会生成POCl3(三氯氧磷),所以向通入CO2 将空气赶走,白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,然后在加入白磷,氯气最后通,白磷熔沸点低,最后加热;
(3)PCl3 的沸点较低,E烧杯中加入冷水的目的是冷却收集PCl3,POCl3和PCl3遇水会强烈水解,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气;
(4)根据表格提供的信息,物质互溶且熔沸点不同,除去PCl3中的POCl3选用的方法是蒸馏法;
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,亚磷酸(H3PO3)是二元弱酸,分别电离,一步比一步艰难,而HCl是强酸,全部电离;
②若将0.01 mol POCl3投入热水配成1 L的溶液,发生的化学反应为POCl3+H2O=H3PO4+3HCl,盐酸是强酸,Cl-浓度为0.03mol/L,H3PO4 是中强酸,分步电离,以第一步电离为主,产生的PO43-的浓度很小,结合溶度积,逐滴加入AgNO3溶液,则先产生的沉淀是AgCl.
解答 解:(1)实验室制取氯气用浓盐酸与MnO2 在加热的条件下进行,装置采用固体和液体加热制取气体的装置,所以实验过程中所用的玻璃仪器除酒精灯和玻璃导气管外,还需要的玻璃仪器有:圆底烧瓶和分液漏斗;水和硫酸铜反应生成蓝色的硫酸铜,干燥的氯气没有漂白性,所以证明通入的氯气是干燥的方法是:将气体通过装有无水硫酸铜的U形管(干燥管),若白色粉末未变蓝,则气体干燥,或者将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的,
故答案为:圆底烧瓶和分液漏斗;将气体通过装有无水硫酸铜的U形管(干燥管),若白色粉末未变蓝,则气体干燥(或者通入装有干燥的有色布条的集气瓶,布条不褪色等,或者将氯气通入装有干燥的有色布条的集气瓶,布条不褪色,说明氯气是干燥的,合理答案均可);
(2)PCl3遇O2会生成POCl3(三氯氧磷),所以向通入CO2 将空气赶走,白磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5,然后在加入白磷,氯气最后通,白磷熔沸点低,最后加热,具体操作为:先打开K2,等反应体系中充满CO2后,加入白磷,然后再打开K1,通入氯气,加热,
故答案为:先打开K2,等反应体系中充满CO2后,加入白磷,然后再打开K1,通入氯气,加热;
(3)PCl3 的沸点较低,所以E烧杯中加入冷水的目的是冷却收集PCl3,POCl3和PCl3遇水会强烈水解,干燥管中碱石灰的作用是吸收多余的氯气和空气中的水蒸气,防止空气中的水蒸气进入收集PCl3的仪器中,
故答案为:冷却收集PCl3;吸收多余的氯气并防止空气中的水蒸气进入收集PCl3的仪器中;
(4)根据表格提供的信息,它们互溶且熔沸点不同,所以除去PCl3中的POCl3制备纯净的PCl3可选用的方法是蒸馏法,
故选:C;
(5)①PCl3遇水会强烈水解生成H3PO3和HCl,亚磷酸(H3PO3)是二元弱酸,分别电离,一步比一步艰难,而HCl是强酸,全部电离,溶液中离子浓度顺序为:c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-),
故答案为:c(H+)>c(Cl-)>c(H2PO3-)>c(HPO32-);
②若将0.01 mol POCl3投入热水配成1 L的溶液,发生的化学反应为POCl3+H2O=H3PO4+3HCl,盐酸是强酸,Cl-浓度为0.03mol/L,H3PO4 是中强酸,分步电离,以第一步电离为主,产生的PO43-的浓度很小,根据Ksp(Ag3PO4)=1.4×10-16,Ksp(AgCl)=1.8×10-10,逐滴加入AgNO3溶液,则先产生的沉淀是AgCl,
故答案为:AgCl.
点评 本题考查氯气的实验室制法、PCl3的制备、离子浓度的大小比较、沉淀溶解平衡等知识,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,难度中等.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
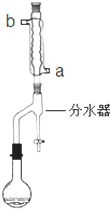 在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:
在苹果、香蕉等水果的果香中存在着乙酸正丁酯.某化学课外兴趣小组欲以乙酸和正丁醇为原料合成乙酸正丁酯.实验步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的能量一定高于N | |
| B. | X、Y的能量总和高于M、N的能量总和 | |
| C. | 因为该反应为放热反应,故不必加热就可发生 | |
| D. | 断裂X、Y的化学键所吸收的能量高于形成M、N的化学键所放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF电离:HF(aq)?H+(aq)+F-(aq)△H=+10.4kJ/mol | |
| B. | 水解消耗0.1mol F-时,吸收的热量为6.77kJ | |
| C. | 中和热均为57.3 kJ/mol | |
| D. | 含0.1mol HF、0.1mol NaOH 的两种溶液混合后放出的热量为6.77kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓H2SO4有强氧化性,常温下能与Cu发生剧烈反应 | |
| B. | 金刚石是自然界中硬度最大的物质,不可能与氧气发生反应 | |
| C. | 明矾[KAl(SO4)2•12H2O]在水中能形成Al(OH)3胶体,可用作净水剂 | |
| D. | 将SO2通入品红溶液中,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质在酶的作用下水解的最终产物为氨基酸 | |
| B. | 向蛋白质溶液加入(NH4)2SO4浓溶液,会使其变性 | |
| C. | 天然蛋白质仅由碳、氢、氧、氮四种元素组成 | |
| D. | 氨基酸和蛋白质都是只能和碱反应的酸性物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com