
【题目】(10分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等。请回答下列问题:

(1)T的原子结构示意图为 。
(2)元素的非金属性(原子的得电子能力):Q W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
【答案】(每空2分,共10分)
(1)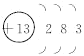 (2)弱于 (3)S+2H2SO4(浓)
(2)弱于 (3)S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
(4)2H2O2![]() 2H2O+O2↑; (5)NaNO2。
2H2O+O2↑; (5)NaNO2。
【解析】试题分析:T所处的周期序数与主族序数相等,则T是Al元素,根据元素的位置关系可确定:Q是C;R是N,W是S. (1)T的原子核外电子排布是2、8、3,所以原子结构示意图为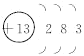 。(2)元素的非金属性越强,得到电子的能力越强,最高价含氧酸的酸性越强。根据酸性H2SO4>H2CO3,可确定元素的非金属性:Q<W;(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,则根据电子守恒、原子守恒,可得该反应的化学方程式为S+2H2SO4(浓)
。(2)元素的非金属性越强,得到电子的能力越强,最高价含氧酸的酸性越强。根据酸性H2SO4>H2CO3,可确定元素的非金属性:Q<W;(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,则根据电子守恒、原子守恒,可得该反应的化学方程式为S+2H2SO4(浓)![]() 3SO2↑+2H2O。(4)原子序数比R多1的元素是O,O的一种氢化物能分解为它的另一种氢化物,该分解反应的化学方程式是2H2O2
3SO2↑+2H2O。(4)原子序数比R多1的元素是O,O的一种氢化物能分解为它的另一种氢化物,该分解反应的化学方程式是2H2O2![]() 2H2O+O2↑;(5)R有多种氧化物,其中甲的相对分子质量最小为NO,在一定条件下,2 L的甲气体与0.5 L的氧气相混合,会发生反应:2NO+O2=2NO2,V(O2)=" 0.5" L,反应消耗V(NO)=1L,产生V(NO2)=1L,则反应后气体为NO、NO2等物质的量的混合气体。若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则发生反应为:NO+NO2+2NaOH=2NaNO2+H2O,所生成R的含氧酸盐化学式是NaNO2。
2H2O+O2↑;(5)R有多种氧化物,其中甲的相对分子质量最小为NO,在一定条件下,2 L的甲气体与0.5 L的氧气相混合,会发生反应:2NO+O2=2NO2,V(O2)=" 0.5" L,反应消耗V(NO)=1L,产生V(NO2)=1L,则反应后气体为NO、NO2等物质的量的混合气体。若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,则发生反应为:NO+NO2+2NaOH=2NaNO2+H2O,所生成R的含氧酸盐化学式是NaNO2。


科目:高中化学 来源: 题型:
【题目】能用H++OH-=H2O来表示的化学反应是( )。
A.CH3COOH+NaOH==CH3COONa+H2O
B.HNO3+KOH=KNO3+H2O
C.H2SO4+Ba(OH)2=BaSO4↓+2H2O
D.2HCl+Cu(OH)2=CuCl2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂用 FeCl3 溶液腐蚀镀有铜的绝缘板生产印刷电路。课外活动小组为确认生产后的废液的组成,进行如下实验:(1)取10mL 废液加入足量的 AgNO3 溶液,生成沉淀 8.61g。(2)另取 10mL废液放入铜片充分反应,铜片质量减少了0.256g。下列关于原废液组成的判断错误的是
A. 一定含有 Fe 2+、 Fe 3+、 Cu2+、 Clˉ B. c(Fe2+):c(Cu2+) = 2:1
C. c(Clˉ) = 6mol / L, c(Fe 2+) = 1.2mol / L D. c (Fe2+):c(Fe 3+) = 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾由多种污染物形成,其中包含颗粒物(包括PM2.5在内)、氮氧化物(NOx)、CO、SO2等。化学在解决雾霾污染中有着重要的作用。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol -1
2SO3(g) ΔH=-196.6 kJ·mol -1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于恒温恒容的密闭容器中发生上述反应,测得上述反应平衡时NO2与SO2体积比为1:5,则平衡常数K= 。
(2)下图是一种用NH3脱除烟气中NO的原理。
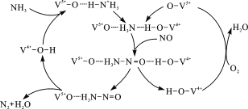
①该脱硝原理中,NO最终转化为H2O和_____________(填化学式)。
②当消耗1 mol NH3和0.5 molO2时,除去的NO在标准状况下的体积为__________L。
(3)NO直接催化分解(生成N2和O2)也是一种脱硝途径。在不同条件下,NO的分解产物不同。在高压下,NO在40℃下分解生成两种化合物,体系中各组分物质的量随时间变化曲线如右图所示,写出NO分解的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.H2+CuO═Cu+H2O
B.2Na2O2+2H2O═4NaOH+O2↑
C.H2+Cl2═2HCl
D.2NaOH+Cl2═NaCl+NaClO+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在常温常压下:
①CH3CH2OH(l)+3O2(g)![]() 2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
2CO2(g)+3H2O(g) ΔH1=-1366kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3=-44kJ·mol-1
④CH3CH2OH(l)+2O2(g)![]() 2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
2CO(g)+3H2O(l) ΔH4=-932kJ·mol-1
则 CO的燃烧热 ΔH =_________。
在图中画出,不同温度下(T1>T2),上述反应④中O2的平衡转化率随压强变化的关系图(请在图上标注温度T1、T2)。_________
(3)一定条件下,在体积为3 L的密闭容器中反应CO(g) + 2H2(g)![]() CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。
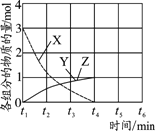
①反应的平衡常数表达式K=__________;根据下图,升高温度,K值将___________(填“增大”、“减小”或“不变”)。

②500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是________。
③X点与Y点的平均速率:v(X)_________v(Y);其中X点的正反应速率v正(X)与Z点的逆反应速率v逆(Z)的大小关系为v正(X)________v逆(Z)(填“>”、“<”、“=”)。
④300℃时能够说明该可逆反应达到化学平衡状态的标志是____________ (填字母)。
a.v生成(CH3OH) = v生成(H2) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度相等
⑤500℃时,将容器的容积压缩到原来的1/2,在其他条件不变的情况下,对平衡体系产生的影响是___________。(填字母)
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的百分含量增加 d.重新平衡时c(H2)/ c(CH3OH)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于物质的类别,下列说法正确的是
A.食盐水、糖水、冰水都属于混合物
B.烧碱、火碱、消石灰都属于碱
C.KHSO4、HCl、HNO3在水中都能电离出氢离子,都属于酸
D.溶液、胶体、浊液都属于稳定的分散系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向18.4g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3g沉淀.另取等质量的合金,使其与一定量的氯气恰好完全反应,则氯气的体积在标准状况下为
A.7.84L B.6.72L C.4.48L D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1) 物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中CH3COO-和Na+浓度相等,则醋酸体积__________氢氧化钠溶液体积 (填“>”“=”“<”)。
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液,溶液中c(Na+)___________c(CH3COO-)(填“>”“=”“<”)。
(3)某温度(t℃)时,水的KW=10-13,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,若所得混合液为中性,则a∶b___________;若所得混合液的pH=2,则a∶b___________。
(4)室温下,若某pH值的硫酸溶液中水电离的c(H+)=1.0×10-amol·L-1,而相同pH值的硫酸铝溶液中水电离出的c(H+)=1.0×10-b mol·L-1,(已知a.b均小于14的正整数),那么a和b之间满足的数量关系是____________(用一个等式和一个不等式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com