
【题目】下列各组混合物构成的溶液,加入Ba(OH)2 溶液,生成沉淀的物质的量变化趋势符合图示的( )
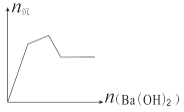
A. Al2(SO4)3、AlCl3 B. KAl(SO4)2、Al2(SO4)3 C. Al2(SO4)3、Fe2(SO4)3 D. FeCl3、AlCl3
【答案】A
【解析】
D中沉淀为氢氧化铁和氢氧化铝,沉淀的物质的量应是先增大后减小,最后不变,图像不符合,D错误;由反应Al2(SO4)3+ 3Ba(OH)2=2Al(OH)3↓+3BaSO4↓可知,若只有Al2(SO4)3,沉淀的物质的量也是先增大后减小,最后不变,图像不符合;若Al2(SO4)3中混有Fe2(SO4)3,结果与Al2(SO4)3一样,C不符合图像要求;若Al2(SO4)3中混有AlCl3,则会在沉淀的物质的量增大的过程中出现拐点,即A符合;若Al2(SO4)3中混有KAl(SO4)2 ,由于2KAl(SO4)2+ 3Ba(OH)2=2Al(OH)3↓+3BaSO4↓+K2SO4,KAl(SO4)2+ 2Ba(OH)2=KAlO2+2 BaSO4↓+2H2O,随着Ba(OH)2的加入,生成的沉淀的物质的量反而减小,和图像不符合,即B错误;
正确选项A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)已知在常温常压下:
①CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH=-354.8 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
则表示CH3OH(l)燃烧热的热化学方程式为______________________________________。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,充电一次可使手机连续使用一个月。
①该电池负极的电极反应式为________________________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)。阳极上最先发生的反应为___________________________;从各阶段的电解总反应方程式来看,最初是电解__________(填写化学式,下同)溶液,然后是电解________溶液,最后是电解H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q是原子序数依次增大的五种短周期元素,X是原子半径最小的元素,Y的气态氢化物能与其最高价氧化物的水化物反应生成盐,Z为地壳中含量最多的元素,R的单质在CO2燃烧生成两种固体,Y、Z、Q的最外层电子数之和为18。请回答下列问题:
(1)Z在元素周期表中的位置为__________。
(2)Z、R、Q离子半径从大到小的顺序为__________。(填离子符号);
(3)X、Z两元素形成的原子个数比为1:1的化合物的电子式为__________。
(4)R3Y2与水可剧烈反应,产生沉淀和气体,反应的化学方程式为__________。
(5)元素Y与X形成一种离子YX4+,请写出检验溶液中该离子的实验操作、现象和结论__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素.根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图________。
(2)写出化合物E2F2的电子式________。
(3)根据题目要求完成以下填空:BF32﹣中心原子杂化方式________;D3中心原子杂化方式________;FD42﹣微粒中的键角________;FD3分子的立体构型________。
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有________、________(要求写一种分子和一种离子)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸的物质的量浓度为_______________mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_______。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.1 mol/L稀盐酸。
①该学生需要量取_____________ mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填 “偏高”或“偏低”或“无影响”)。
a、用量筒量取浓盐酸时俯视观察凹液面。(____________)
b、用量筒量取浓盐酸后,洗涤量筒2-3次,洗涤液也转移到容量瓶。(_________)
(4)现将100mL 0.5mol/L的盐酸与200mL 0.1mol/LCuCl2溶液混合,体积变化忽略不计,所得溶液中Cl-的物质的量浓度是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关苯的性质描述中,正确的是( )
A.苯能使酸性高锰酸钾溶液褪色
B.苯与稀硝酸、稀硫酸混合加热,生成硝基苯
C.苯与溴水混合振荡,静置,下层液体几乎为无色
D.1 mol苯与2 mol氢气发生加成反应生成1 mol环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe2+、CO32、SO42、Cl中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 向原溶液中加K3Fe(CN)6溶液,无明显现象
B. 原溶液中c(Cl-)≥0.1mol˙L-1
C. 用洁净的铂丝蘸取原溶液,在酒精灯上灼烧,火焰呈黄色
D. 将湿润的红色石蕊试纸靠近实验产生的气体,试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组在实验室进行了一次有趣的反应过程:物质A经一系列的反应又回到了A。请回答下列问题。
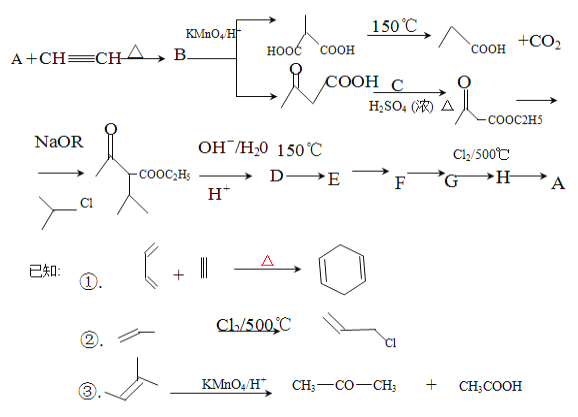
(1)下列说法正确的是_______。
A.A存在顺反异构 B.B能够发生加聚反应 C.C是乙酸 D.D的分子式C7H10O3
(2)A的结构简式_____________________________。
(3)上述循环流程中有机物的所有含氧官能团除羧基、酯基外还有____________________。
(4)C参与的这步反应的反应类型_____________________。
(5)E的同分异构体中能发生银镜反应的有______________种。
(6)写出D生成E的化学反应方程式 ________________________________。
(7)参考题中流程写出F到A的流程图(写出F、G、H、A的结构,注明反应条件)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~M有如图所示转化关系,A(C9H9O2X)与F分子中所含碳原子数相同,且A均能与NaHCO3溶液反应;F的分子式为C9H10O2且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。
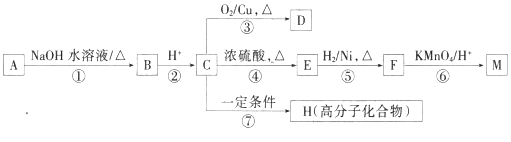
已知:![]() (R1、R2代表烃基或氢原子)
(R1、R2代表烃基或氢原子)
请回答:
(1)化合物D中含氧官能团的名称为____________________________。
(2)写出下列反应类型:反应①____________________;反应④__________________。
(3)写出下列物质的结构简式:B_________________;M______________________。
(4)D发生银镜反应的化学方程式为________________________________________。
(5)反应⑦的化学方程式为_______________________________________________。
(6)确定A中X原子的实验步骤和现象为_______________________________________。
(7)符合下列条件的E的同分异构体共有________种。
a.能发生银镜反应 b.能与FeCl3溶液发生显色反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com