
【题目】某100mL溶液可能含有Na+、NH4+、Fe2+、CO32、SO42、Cl中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 向原溶液中加K3Fe(CN)6溶液,无明显现象
B. 原溶液中c(Cl-)≥0.1mol˙L-1
C. 用洁净的铂丝蘸取原溶液,在酒精灯上灼烧,火焰呈黄色
D. 将湿润的红色石蕊试纸靠近实验产生的气体,试纸变蓝
【答案】C
【解析】
根据流程分析可知:100mL溶液加入氯化钡溶液产生的沉淀1为4.30g,加入盐酸后,沉淀2质量变为2.33g,说明原溶液中含有:CO32、SO42;滤液加入氢氧化钠溶液,产生气体氨气,原溶液中含有NH4+;所以原溶液中一定含有CO32、SO42、NH4+,一定不含Fe2+;
A. 综合上述分析可知,原溶液中一定不含Fe2+,向原溶液中加K3Fe(CN)6溶液,无明显现象,A正确;
B. 硫酸钡沉淀2.33g,n(SO42)= n(BaSO4)=2.33/233=0.01mol, n(CO32)= n(BaCO3)=(4.30-2.33)/197=0.01mol,n(NH4+)= n(NH3)=1.12/22.4=0.05mol,根据电荷守恒可知,0.01×2+0.01×2<0.05×1,所以溶液中含有Cl;如果溶液中还含有阳离子Na+,则原溶液中c(Cl-)≥0.1mol˙L-1,B正确;
C. 根据(B)分析可知,溶液中不一定含Na+,C错误;
D. 通过以上分析可知,溶液中含有NH4+,加入强碱后加热,产生的气体能够将湿润的红色石蕊试纸试纸变蓝,该气体为氨气,D正确;
正确选项C。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】为了除去KC1固体中少量MgSO4和CaCl2杂质,需进行下列六项操作: ①加水溶解;②加热蒸发得到晶体;③加入过量BaCl2溶液;④加入过量盐酸;⑤加入过量K2CO3溶液;⑥过滤; 正确的顺序是
A. ①⑤③⑥④② B. ①⑤③④⑥② C. ①③④⑥⑤② D. ①③⑤⑥④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法错误的是
)是最简单的一种。下列关于该化合物的说法错误的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过两种
C. 所有碳原子均处同一平面
D. 生成1 molC5H12至少需要2 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组混合物构成的溶液,加入Ba(OH)2 溶液,生成沉淀的物质的量变化趋势符合图示的( )
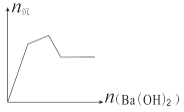
A. Al2(SO4)3、AlCl3 B. KAl(SO4)2、Al2(SO4)3 C. Al2(SO4)3、Fe2(SO4)3 D. FeCl3、AlCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,反应前后溶液颜色不发生变化的是( )
A.乙烯通入酸性高锰酸钾溶液
B.氯气用足量氢氧化钠溶液吸收
C.铁粉投入硫酸铜溶液
D.淀粉和碘化钾混合溶液中通入氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种元素的性质或原子结构的相关叙述如表所示。
元素 | 元素性质或原子结构的相关叙述 |
T | 失去1个电子后,形成与Ne相同的核外电子排布 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 其某种单质是空气的主要成分,也是最常见的助燃剂 |
Z | 原子核外有3个电子层,最外层比次外层少1个电子 |
回答下列问题:
(1)写出工业上用X的单质来制备粗硅的化学方程式_________________________。
(2)Y形成的另一种单质主要存在于地球的平流层中,被称作地球生物的保护伞,该单质的化学式是________。
(3)元素Z在海水中含量非常高,海水中含Z元素的化合物主要是__________(写化学式)。
(4)画出T原子的结构示意图:____________。
(5)T元素组成的单质在Y元素组成的常见单质中燃烧,得到的产物的化学式是________,电子式是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬是重要的战略物质之一,由于具有质硬,耐磨,耐高温,抗腐蚀性等特性,所以在工业上应用比较广泛,在冶金工业上主要用铬铁矿(Cr2O3 、FeO、SiO2 、Al2O3 等,其它杂质不参加反应)生产铬和铁等金属。流程如下:
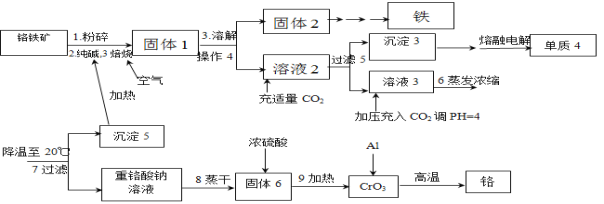
已知:2Cr2O3+3O2+4Na2CO3![]() 4Na2CrO4+4CO2;部分物质的溶解度(单位g)
4Na2CrO4+4CO2;部分物质的溶解度(单位g)
0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | |
Na2CO3 | 7.0 | 13 | 29 | 40 | 49 | 46 | 44 |
NaHCO3 | 6.9 | 8.5 | 9.6 | 11.1 | 12.7 | 14.4 | 16.9 |
Na2Cr2O7 | 161 | 170 | 183 | 198 | 218 | 240 | 265 |
(1)粉碎的目的
(2)写出焙烧时含铝物质发生的化学反应方程式_______________________________;
(3)操作4是_______________________,沉淀3含有的物质有_____________________;
(4)写出生成沉淀5的离子方程式_____________________________________________;
(5)整个流程可以循环使用的物质有___________________________;
(6)最后一步制备金属铬的化学方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 某元素的氯化物
某元素的氯化物![]() 溶于水制成溶液后,加入
溶于水制成溶液后,加入![]() 溶液恰好完全反应。已知该元素原子核内有20个中子,求X元素的质子数___和质量数___,并写出X元素在元素周期表中的位置(简要写出计算过程)___。
溶液恰好完全反应。已知该元素原子核内有20个中子,求X元素的质子数___和质量数___,并写出X元素在元素周期表中的位置(简要写出计算过程)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将2mol气体A和1mol气体B充入容积为2L的恒容密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g),2min时化学反应达到平衡(温度仍为t℃),此时B还有 0.6mol,并测得C的浓度为0.6mol/L。请回答下列问题:
xC(g),2min时化学反应达到平衡(温度仍为t℃),此时B还有 0.6mol,并测得C的浓度为0.6mol/L。请回答下列问题:
(1)判断该反应达到平衡的标志是______。
a.容器中的压强保持不变 b.A的生成速率与B的消耗速率之比为2:1
c.容器内混合气体的密度保持不变 d.A的百分含量保持不变
e.B和C的物质的量浓度之比为1:x
(2)x=___, 从反应开始到达到平衡时,用B表示该反应的平均反应速率v(B)=____;
(3)化学反应达到平衡时,A的转化率为_____。
(4)某化学兴趣小组同学为了研究上述反应的反应速率,他们将A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的曲线。
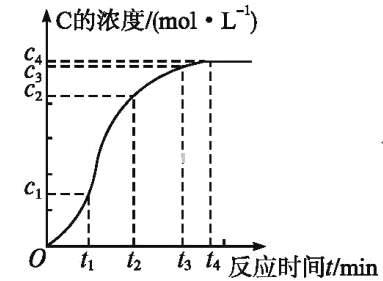
在O~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的时间段是____,从反应速率的变化可看出该反应可能是____(填“放热”或“吸热”)反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com