
【题目】为了除去KC1固体中少量MgSO4和CaCl2杂质,需进行下列六项操作: ①加水溶解;②加热蒸发得到晶体;③加入过量BaCl2溶液;④加入过量盐酸;⑤加入过量K2CO3溶液;⑥过滤; 正确的顺序是
A. ①⑤③⑥④② B. ①⑤③④⑥② C. ①③④⑥⑤② D. ①③⑤⑥④②
科目:高中化学 来源: 题型:
【题目】科学家成功合成了新型抗肿瘤铂(Ⅳ)类化合物Pt( HPxSC)Cl3,请回答下列问题:
(1)基态磷原子价电子排布图为__________________。
(2)在元素周期表中,铂元素与铁元素同族,则铂元素位于_________。
A.s区 B.p区 C.d区 D. ds区 E.f区
(3)磷、硫、氯的第一电离能由小到大的顺序为__________________(填化学式)。
(4)与S同族的相邻元素氢化物沸点最高的为_________(填化学式),其原因为_________ 。
(5)铂(Pt)单质晶体中原子的堆积方式如图所示,由图可知,晶体铂的堆积方式为_________,一个晶胞中含有_________个铂原子,距离每个铂原子最近且等距离的铂原子有_________个。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,下列说法正确的是
2AB3(g) ΔH<0,下列说法正确的是
A. 升高温度,正、逆反应速率都加快,且正反应速率加快更明显
B. 升高温度能缩短达到平衡所需的时间且提高A2的转化率
C. 达到平衡后,同时升高温度和增大压强,n(AB3)有可能不变
D. 达到平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知在常温常压下:
①CH3OH(l)+O2(g)===CO(g)+2H2O(g) ΔH=-354.8 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ·mol-1
③H2O(g)===H2O(l) ΔH=-44.0 kJ·mol-1
则表示CH3OH(l)燃烧热的热化学方程式为______________________________________。
(2)由甲醇、氧气和NaOH溶液构成的新型手机电池,充电一次可使手机连续使用一个月。
①该电池负极的电极反应式为________________________________________________。
②若以该电池为电源,用石墨作电极电解200 mL含有如下离子的溶液。
离子 | Cu2+ | H+ | Cl- | SO42- |
c/(mol·L-1) | 0.5 | 2 | 2 | 0.5 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)。阳极上最先发生的反应为___________________________;从各阶段的电解总反应方程式来看,最初是电解__________(填写化学式,下同)溶液,然后是电解________溶液,最后是电解H2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 氯化铁溶液中加入足量的氨水:Fe3++3NH3·H2O == Fe(OH)3↓+3NH![]()
B. 氯气和水反应:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
C. 铁和盐酸反应生成氢气:2Fe+6H+ == 2Fe3++3H2↑
D. BaCl2溶液中通入SO2:SO2+Ba2++H2O == BaSO3↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入 1mol N2, 右边充入 CO 和 CO2 的混合气体共 8g 时,隔板处于如图位置(保持温度不变),下列说法正确的是
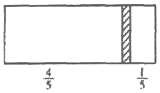
A. 右边 CO 与 CO2 分子数之比为 1:3
B. 右侧 CO 的质量为 2.75g
C. 若改变右边 CO 和 CO2 的充入量而使隔板处于离右端1/6处, 保持温度不变,则前后两次充入容器内的气体压强之比为 5: 3
D. 右侧气体密度是相同条件下氢气密度的 16 倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物中分离出的活性化合物zeylastral的结构简式如图所示,下列说法错误的是( )
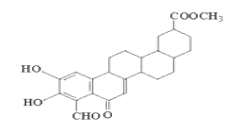
A. 1mol zeylastral最多与5molH2发生反应
B. 能与FeCl3溶液、银氨溶液发生反应
C. 化合物 zeylastral可以发生水解反应
D. 1mol zeylastral可与2molBr2发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、Q是原子序数依次增大的五种短周期元素,X是原子半径最小的元素,Y的气态氢化物能与其最高价氧化物的水化物反应生成盐,Z为地壳中含量最多的元素,R的单质在CO2燃烧生成两种固体,Y、Z、Q的最外层电子数之和为18。请回答下列问题:
(1)Z在元素周期表中的位置为__________。
(2)Z、R、Q离子半径从大到小的顺序为__________。(填离子符号);
(3)X、Z两元素形成的原子个数比为1:1的化合物的电子式为__________。
(4)R3Y2与水可剧烈反应,产生沉淀和气体,反应的化学方程式为__________。
(5)元素Y与X形成一种离子YX4+,请写出检验溶液中该离子的实验操作、现象和结论__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某100mL溶液可能含有Na+、NH4+、Fe2+、CO32、SO42、Cl中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法不正确的是( )

A. 向原溶液中加K3Fe(CN)6溶液,无明显现象
B. 原溶液中c(Cl-)≥0.1mol˙L-1
C. 用洁净的铂丝蘸取原溶液,在酒精灯上灼烧,火焰呈黄色
D. 将湿润的红色石蕊试纸靠近实验产生的气体,试纸变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com