
【题目】下列哪一实例能说明微量元素是生命活动所必需的( )
A.Mg是叶绿素不可缺少组成成分
B.哺乳动物血液中Ca2+盐含量太低会抽搐
C.油菜缺少B时只开花不结果
D.人体内Mn的含量过高会导致运动失调
科目:高中化学 来源: 题型:
【题目】下列关于反应热和热化学反应的描述中正确的是
A. 1 mol甲烷燃烧生成气态水和二氧化碳时所放出的热量是甲烷的燃烧热
B. CO(g)的燃烧热是283.0 kJ·mol-1,则反应2CO2(g)![]() 2CO(g)+O2(g) ΔH=+2×283.0 kJ·mol-1
2CO(g)+O2(g) ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)![]() 2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
D. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热 ΔH=2×(-57.3) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化合物![]() (b)、
(b)、![]() (d)、
(d)、![]() (p)的下列说法正确的是
(p)的下列说法正确的是
A. b、d、p都属于芳香烃,且互为同分异构体
B. b、d、p的一氯代物均只有三种
C. b、d、p均可与溴的四氯化碳溶液反应
D. b、d、p中b、d的所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器能直接用酒精灯加热的是( )
①量简 ②表面皿 ③烧杯 ④试管 ⑤容量瓶 ⑥蒸发皿 ⑦坩埚 ⑧烧瓶
A.②③④⑤⑥⑦⑧B.③⑥⑦C.④⑥⑦D.④⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______(填1、2、3、4),三种非金属原子的电负性由大到小的顺序为____(用相应的元素符号表示);氮原子的杂化轨道类型为____。
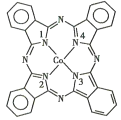
(3)Fe(CO)x,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于_____(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO____FeO(填“>”“<”或“=”),原因是____________。
(5)NiAs的晶胞结构如图所示:
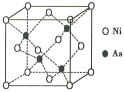
①镍离子的配位数为__________。
②若阿伏加德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为______cm。(写出计算表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
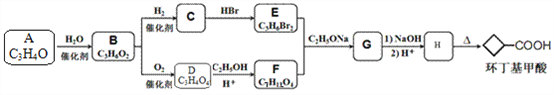
【题目】环丁基甲酸(![]() )是有机合成中一种重要的中间体。实验室以链状分子A为原料合成环丁基甲酸的路线如下:
)是有机合成中一种重要的中间体。实验室以链状分子A为原料合成环丁基甲酸的路线如下:
已知: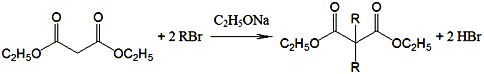
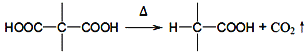
请回答下列问题:
(1)化合物A的化学名称是______,由A生成B的反应类型是_______。
(2)化合物B中所含官能团的名称为___________。
(3)化合物C和D反应所形成高聚物的结构简式是___________。
(4)写出E+F→G的化学方程式: ___________。
(5)X是环丁基甲酸的同分异构体,能与饱和碳酸氢钠溶液反应放出气体,且能使溴水褪色,X共有______种;其中核磁共振氢谱为三组峰,峰面积比为6:1:1的结构简式为___________。
(6)写出用1,3一丁二烯和化合物F为原料制备环戊基甲酸的合成路线___________。(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O.下列说法中正确的是( )
A. KClO3在反应中是还原剂
B. 1 mol KClO3参加反应,在标准状况下能得到22.4 L气体
C. 在反应中H2C2O4既不是氧化剂也不是还原剂
D. 1 mol KClO3参加反应有1 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或有关化学用语的表达正确的是( )
A. 在基态多电子原子中,p轨道电子能量一定高于s轨道电子能量
B. 基态Fe原子的外围电子排布图为![]()
C. 因氧元素电负性比氮元素大,故氧原子第一电离能比氮原子第一电离能大
D. 根据原子核外电子排布的特点,Cu在元素周期表中位于s区
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com