
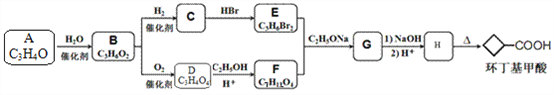
【题目】环丁基甲酸(![]() )是有机合成中一种重要的中间体。实验室以链状分子A为原料合成环丁基甲酸的路线如下:
)是有机合成中一种重要的中间体。实验室以链状分子A为原料合成环丁基甲酸的路线如下:
已知: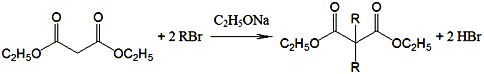
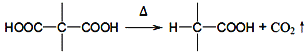
请回答下列问题:
(1)化合物A的化学名称是______,由A生成B的反应类型是_______。
(2)化合物B中所含官能团的名称为___________。
(3)化合物C和D反应所形成高聚物的结构简式是___________。
(4)写出E+F→G的化学方程式: ___________。
(5)X是环丁基甲酸的同分异构体,能与饱和碳酸氢钠溶液反应放出气体,且能使溴水褪色,X共有______种;其中核磁共振氢谱为三组峰,峰面积比为6:1:1的结构简式为___________。
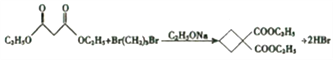
(6)写出用1,3一丁二烯和化合物F为原料制备环戊基甲酸的合成路线___________。(其他试剂任选)。
【答案】 丙烯醛或2-丙烯醛 加成反应 醛基、羟基 ![]()
 8 (CH3)2C=CHCOOH
8 (CH3)2C=CHCOOH 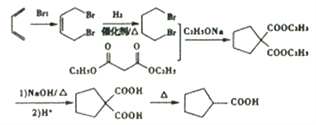
【解析】分析:根据流程图,链状分子A(C3H4O),能够与水反应生成B(C3H6O2),说明A中含有碳碳双键,则A的结构简式为CH2=CHCHO,B氧化生成D,D与乙醇在酸性溶液中发生酯化反应生成F,根据F的化学式,说明D为二元羧酸,则D为HOOCCH2COOH,B为HOCH2CH2CHO,F为CH3CH2OOCCH2COOCH2CH3;B与氢气发生还原反应生成C,C与HBr反应生成二溴代烃,则C为二元醇,C为HOCH2CH2CH2OH,E为BrCH2CH2CH2Br,根据信息,E和F反应生成G,G为![]() ,G水解生成H,H为
,G水解生成H,H为![]() ,根据信息,H受热脱去一个羧基生成环丁基甲酸。
,根据信息,H受热脱去一个羧基生成环丁基甲酸。
详解:(1) A为CH2=CHCHO,化学名称为丙烯醛, A(C3H4O)与水反应生成B(C3H6O2),属于加成反应,故答案为:丙烯醛;加成反应;
(2) B为HOCH2CH2CHO,所含官能团有醛基、羟基,故答案为:醛基、羟基;
(3) C为HOCH2CH2CH2OH,D为HOOCCH2COOH,C和D发生缩聚反应所形成高聚物的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(4) E为BrCH2CH2CH2Br,F为CH3CH2OOCCH2COOCH2CH3;根据信息,E和F反应生成G(![]() )的化学方程式为
)的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)X是环丁基甲酸(![]() )的同分异构体,能与饱和碳酸氢钠溶液反应放出气体,说明含有羧基;能使溴水褪色,说明含有碳碳双键,因此满足条件的X有CH3CH2CH=CHCOOH、CH3CH=CHCH2COOH、CH2=CHCH2CH2COOH、CH2=C(CH3)CH2COOH、 (CH3)2C=CHCOOH、CH3C=C(CH3)COOH、CH2=CHCH(CH3)COOH、CH2=CH(CH2CH3)COOH,共8种,其中核磁共振氢谱为三组峰,峰面积比为6:1:1的结构简式为(CH3)2C=CHCOOH,故答案为:8;(CH3)2C=CHCOOH;
)的同分异构体,能与饱和碳酸氢钠溶液反应放出气体,说明含有羧基;能使溴水褪色,说明含有碳碳双键,因此满足条件的X有CH3CH2CH=CHCOOH、CH3CH=CHCH2COOH、CH2=CHCH2CH2COOH、CH2=C(CH3)CH2COOH、 (CH3)2C=CHCOOH、CH3C=C(CH3)COOH、CH2=CHCH(CH3)COOH、CH2=CH(CH2CH3)COOH,共8种,其中核磁共振氢谱为三组峰,峰面积比为6:1:1的结构简式为(CH3)2C=CHCOOH,故答案为:8;(CH3)2C=CHCOOH;
(6)以1,3-丁二烯和CH3CH2OOCCH2COOCH2CH3为原料可制备环戊基甲酸(![]() ),根据题干流程图提供的信息,可以用1,3-丁二烯首先制备二溴代烃,再与E反应生成
),根据题干流程图提供的信息,可以用1,3-丁二烯首先制备二溴代烃,再与E反应生成![]() ,然后水解生成
,然后水解生成![]() ,最后加热脱羧即可,合成路线为:
,最后加热脱羧即可,合成路线为: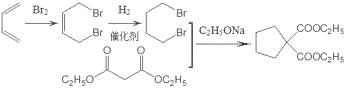
![]() ,故答案为:
,故答案为:
![]() 。
。


 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料。通过下列反应可以制备甲醇:CO ( g ) + 2H2( g )CH3OH ( g ) △H=-90.8 kJ·mol-1在一容积可变的密闭容器中充入10 mol CO 和20 molH2,CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A时,容器的体积为20 L。
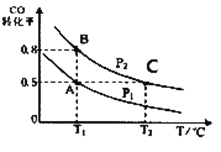
(1)该反应的化学平衡常数表达式为_____________。
(2)图中正反应速率:ν(A)___ν(B);平衡常数: K(A)_____K(C);平均摩尔质量:M(B)_____M(C)(填“>”、“<”或“=”)。
(3)关于反应CO(g)+2H2(g) CH3OH(g)在化学平衡状态时的描述正确的是_______(填字母)。
A.CO的含量保持不变
B.2V正(CH3OH)=V正(H2)
C.容器中CH3OH浓度与CO浓度相等
D.容器中混合气体的密度保持不变
(4)如反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)为__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A元素的原子中只有一个能层且只含1个电子;B元素的原子3p轨道上得到1个电子后不能再容纳外来电子;C元素的原子的2p轨道上有1个电子的自旋方向与其他电子的自旋方向相反;D元素的原子第三能层上有8个电子,第四能层上只有1个电子;E元素原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式: (至少写出5个)。
(2)写出用上述元素组成的物质制得A的单质的化学方程式: 、
(3)检验某溶液中是否含有D+,可通过 反应来实现;检验某溶液中是否含有B-,通常所用的试剂是 和 。
(4)写出E的元素符号: ,要证明太阳上是否含有E元素,可采用的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列哪一实例能说明微量元素是生命活动所必需的( )
A.Mg是叶绿素不可缺少组成成分
B.哺乳动物血液中Ca2+盐含量太低会抽搐
C.油菜缺少B时只开花不结果
D.人体内Mn的含量过高会导致运动失调
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 酸性氧化物 | |
A | 纯碱 | 盐酸 | 烧碱 | 二氧化硫 |
B | 烧碱 | 硫酸 | 食盐 | 一氧化碳 |
C | 苛性钠 | 醋酸 | 石灰石 | 水 |
D | 苛性钾 | 碳酸 | 苏打 | 三氧化硫 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是 ( )。
A.氢铝化合物与水反应生成氢氧化铝和氢气
B.氢铝化合物中铝显+3价,氢显-1价
C.铝与水蒸气在高温下反应可生成氢铝化合物
D.氢铝化合物具有强还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)碳原子的核外电子排布式为____________。与碳同周期的非金属元素N的第一电离能大于O的第一电离能,原因是_________________。
(2)A、B均为短周期金属元素。依据下表数据,写出B原子的电子排布式:________。

(3)下表是第三周期部分元素的电离能[单位:eV(电子伏特)]数据。
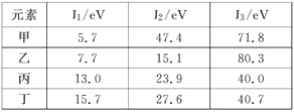
下列说法正确的是________(填字母)。
A.甲的金属性比乙强 B.乙的化合价为+1价
C.丙不可能为非金属元素 D.丁一定为金属元素
(4)Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据列于下表:
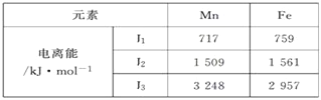
锰元素位于第四周期第ⅦB族。请写出基态Mn2+的价电子排布式:________,比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向lL0.lmol·L-1一元酸HR溶液中逐渐通人氨气[已知常温下Kb(NH3H2O)=1.76×10-5],使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如右图所示。下列叙述正确的是( )
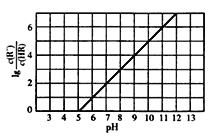
A. 0.1 mol·L-1HR溶液的pH约为3
B. HR为弱酸,常温时Ka (HR)=1×l0-7
C. 当通入0.1molNH3时,c(R-)>c(NH4+)
D. 当c(HR) =c(R-)时,溶液必为中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com