
【题目】常温下,下列各组离子在特定溶液中一定能大量共存的是
A.pH=12的澄清的溶液中:K+、Na+、MnO![]() 、SO
、SO![]()
B.c(Al3+)=0.1molL﹣1的溶液中:Na+、Cl﹣、HCO![]() 、SO
、SO![]()
C.甲基橙呈红色的溶液中:NH![]() 、Ba2+、AlO
、Ba2+、AlO![]() 、Cl﹣
、Cl﹣
D.加入少量铝粉后能产生氢气的溶液中:NH![]() 、Fe2+、NO
、Fe2+、NO![]() 、SO
、SO![]()
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定。
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体______g。
(2)从下表中选择称量NaOH固体所需要的仪器是(填字母):____。
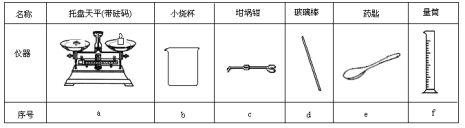
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):_____。
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
温度 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则中和热△H=___(取小数点后一位)。
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院在斯德哥尔摩宣布2019年度诺贝尔化学奖授予在锂离子电池的发展方面做出贡献的科学家。锂电池作为最主要的便携式能量源,影响着我们生活的方方面面。锂空气电池放电的工作原理如图所示。下列叙述正确的是( )
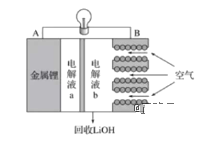
A.电池放电时负极电极方程式为O2+2H2O+4e-=4OH-
B.放电时电子由B极向A极移动
C.电解液a,b之间可采用阴离子交换膜
D.电解液b可能为稀LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某烃A的分子组成和结构,对这种烃进行以下实验:
①取一定量的该烃,使其充分燃烧后的气体通过装有CaCl2干燥管,干燥管增重7.2g;再通过石灰水,石灰水增重17.6g。
②经测定,该烃(气体)在标准状况下的密度为1.25g·L-1。
现以A为主要原料合成乙酸乙酯,其合成路线如图1所示。
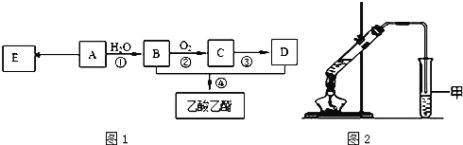
(1)0.1mol该烃A能与 _____g溴发生加成反应;加成产物需 _____mol溴蒸气完全取代;
(2)B中官能团的名称是_____, B可通过加入强氧化剂为_______(任填一种)一步直接氧化为D。
(3)E是常见的高分子材料,写出E的结构简式______;合成E的反应类型______;
(4)某同学用如图2所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。
①实验开始时,试管甲中的导管不伸入液面下的原因是__________;
②上述实验中饱和碳酸钠溶液的作用是________;
③在实验室利用B和D制备乙酸乙酯的实验中,若用1molB和1molD充分反应,不能生成1mol乙酸乙酯,原因是_____。
(5)比乙酸乙酯相对分子质量大14的酯有_____种结构。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各表述与示意图一致的是
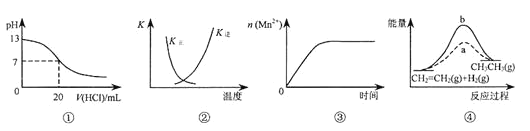
A. 图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1NaOH溶液,溶液的pH随加入酸体积的变化
B. 图②中曲线表示反应2SO2(g) + O2(g)![]() 2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C. 图③表示10 mL 0.01 mol·L-1KMnO4酸性溶液与过量的0.1 mol·L-1H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D. 图④中a、b曲线分别表示反应CH2=CH2(g) + H2(g)![]() CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸苏合香酯![]()

![]() 是配制栀子、晚香玉香型日用香精的主要原料。一种合成乙酸苏合香酯的设计线路如下:
是配制栀子、晚香玉香型日用香精的主要原料。一种合成乙酸苏合香酯的设计线路如下:
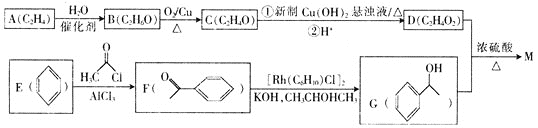
请回答下列问题:
![]() 的名称是________,C中官能团的名称是________。
的名称是________,C中官能团的名称是________。
![]() A→B的反应类型是________,G的分子式为________。
A→B的反应类型是________,G的分子式为________。
![]() 的核磁共振氢谱有________组吸收峰。
的核磁共振氢谱有________组吸收峰。
![]() 写出D与G反应生成M的化学方程式:________________________________________。
写出D与G反应生成M的化学方程式:________________________________________。
![]() 是M的同分异构体,同时符合下列条件的X共有________种。
是M的同分异构体,同时符合下列条件的X共有________种。
![]() 苯环上只有两个取代基
苯环上只有两个取代基 ![]() 能发生银镜反应
能发生银镜反应 ![]() 能发生水解反应
能发生水解反应
![]() 请设计以甲苯和乙酰氯
请设计以甲苯和乙酰氯![]()
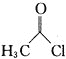
![]() 为原料合成
为原料合成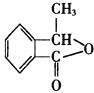 的合理路线______________。已知:若苯环上连烷基,则苯环上的邻、对位的氢原子易被取代;若苯环上连羧基,则苯环上的间位的氢原子易被取代。
的合理路线______________。已知:若苯环上连烷基,则苯环上的邻、对位的氢原子易被取代;若苯环上连羧基,则苯环上的间位的氢原子易被取代。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 W、X、Y、Z 的原子序数依次增大,W、X 原子的最外层电子数之比为 4:3,Z 原子比 X 原子的核外电子数多 4。下列说法正确的是
A.W、Y、Z 的电负性大小顺序一定是 Z>Y>W
B.W、X、Y、Z 的原子半径大小顺序可能是 W>X>Y>Z
C.Y、Z 形成的分子空间构型可能是正四面体
D.WY2 分子中![]() 键与π键的数目之比是 2:1
键与π键的数目之比是 2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体缺乏维生素A,会出现皮肤干燥、夜盲症等症状。维生素A又称视黄醇,分子结构如下图所示,下列说法正确的是

A. 1mol维生素A最多能与7molH2发生加成反应
B. 维生素A不能被氧化得到醛
C. 维生素A是一种易溶于水的醇
D. 维生素A的分子式为C20H30O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案合理的是( )
A. 可用溴水鉴别己烯、己烷和四氯化碳
B. 可用酸性高锰酸钾溶液除去甲烷中混有的杂质乙烯
C. 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应
D. 证明溴乙烷与NaOH醇溶液共热生成乙烯:用如图所示的实验装置

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com