
【题目】室温下,将0.1000 mol·L-1盐酸滴入20.00 mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示,下列说法正确的是
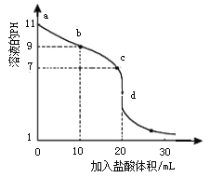
A. b点处的溶液中c(Cl-)>c(M+)>c(OH-)>c(H+)
B. 室温下,MOH的电离平衡常数Kb为1×10-5
C. c点处的溶液中c(M+)=c(Cl-)=c(H+)=c(OH-)
D. d点处的溶液中c(MOH) + c(H+) = c(OH-)
【答案】B
【解析】
20mL时达到滴定终点,则c(MOH)=(0.1000 mol/L×20.00 mL)/20.00 mL=0.1000 mol/L;
A.b点时,溶液pH=9,溶液呈碱性,则c(H+)<c(OH-),根据电荷守恒得c(M+)+c(H+)=c(OH-)+c(Cl-),所以得c(M+)>c(Cl-),故A错误;
B.a点时,MOH溶液中pH=11,则c(OHˉ)=0.001mol/L,MOH是弱碱,电离平衡常数为:Kb= ![]()
![]() =1×10-5,故B正确;
=1×10-5,故B正确;
C. c点处的溶液呈中性,此时溶质为MCl和少量MOH,根据电荷守恒得:c(M+)+c(H+)=c(OH-)+c(Cl-),因为c(H+)= c(OH-),所以得c(M+)=c(Cl-),所以c(M+)=c(Cl-)>c(H+)=c(OH-),故C错误;
D. d点处的溶液中pH值小于7,c(H+)>c(OH-),溶质为MCl,根据物料守恒可得:c(Cl-) = c(M+) +c(MOH),根据电荷守恒得:c(M+)+c(H+)=c(OH-)+c(Cl-),两式结合得:c(H+)=c(OH-)+c(MOH),故D错误;
故选B。


 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用平衡移动原理解释的是
A. 用排饱和食盐水的方法收集氯气
B. SO2催化氧化制SO3的过程中使用过量的氧气,以提高二氧化硫的转化率
C. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
D. 锌与稀硫酸反应,加入少量硫酸铜反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有100mL混合气体,可能由NH3、HCl、CO2、NO组成,将此气体通过浓H2SO4,气体体积减少30mL,再通过固体Na2O2后,气体体积又减少15mL,最后通过水后,变为45mL(同温同压,水蒸气体积不计),则原混合气体中各成份的体积之比:V(NH3):V(HCl):V(CO2):V(NO)正确的是()
A.3∶0∶1∶6B.0∶6∶3∶1C.6∶0∶3∶11D.3∶2∶1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种弱酸的电离平衡常数如下表所示,下列说法正确的是
化学式 | HCOOH | H2CO3 | HCN |
电离平衡常数 | K=1.8×10-4 | K1=4.3×10-7 K2=5.6×10-11 | K=4.9×10-10 |
A. 酸性强弱顺序是:HCOOH > HCN > H2CO3
B. 物质的量浓度均为0.1 mol·L-1的HCOONa溶液和NaCN溶液,pH大小顺序:HCOONa < NaCN
C. HCOOH的电离平衡常数表达式为K=![]()
D. H2CO3溶液和NaCN溶液反应的离子方程式为H2CO3 + 2CN- = 2HCN + CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2A+3B![]() 2C。开始时C的浓度为amol·L-1,2min后C的浓度变为2amol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中不正确的是( )
2C。开始时C的浓度为amol·L-1,2min后C的浓度变为2amol·L-1,A和B的物质的量浓度均变为原来的1/2,则下列说法中不正确的是( )
A.用B表示的反应速率是0.75a mol/(L·min)
B.反应开始时,c(B)=3amol·L-1
C.反应2min后,c(A)=0.5amol·L-1
D.反应2min后,c(B)=1.5amol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2X(g) ![]() Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
Y(g)+Z(g)在4种不同条件下进行,Y、Z起始浓度为0,反应物X的浓度(mol·L-1)随反应时间(min)的变化情况如下表:
化情况如下表:

下列说法不正确的是( )
A. c>1.0 B. 实验2可能使用了催化剂
C. 实验3比实验2先达到化学平衡状态 D. 前10分钟,实验4的平均化学反应速率比实验1的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汞阴极法电解饱和食盐水制取NaOH的原理如图所示。下列说法不正确的是

A.电解室中反应的化学方程式为 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
B.解汞室中反应的离子方程式为 2Na+2H2O=2Na++2OH-+H2↑
C.该方法的缺点是挥发出的汞蒸气会造成环境污染
D.电解室与解汞室产生的气体可用于制取盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差
B. 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应
C. 对于反应①C+CO2![]() 2CO(△H>0)和反应②N2+3H2
2CO(△H>0)和反应②N2+3H2![]() 2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢
2NH3(△H<0),达平衡后,升高温度,①反应速率加快,②反应速率减慢
D. NH4Cl和HCl溶于水后滴加石蕊都变红色,说明它们均能电离出H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染。
已知:①CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g) △H = - 574 kJ/mol
②CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g) △H = - 1160 kJ/mol
③H2O(g) = H2O(l) △H = - 44.0 kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式: _____________________________________________________________。
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________________(填代号)。

(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH=a kJ/mol
N2(g)+CO2(g) ΔH=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(NO)=_____________________;计算该反应的平衡常数K=____________________。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_________(填字母代号)。
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率____________(填“升高”或“降低”),a________0(填“>”或“<”)。
(4)温度T1和T2时,分别将0.50 mol CH4和1.2mol NO2充入1 L的密闭容器中发生反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
N2(g)+CO2(g)+2H2O(g) △H=bkJ/mol。
测得有关数据如下表:
温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是__________________。
A.T1>T2,且b>0
B.当温度为T2、反应进行到40 min时, x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50 mol CH4(g)、0.50 molNO2(g)、1.0 mol N2(g)、2.0 molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com