
【题目】A、B、C、D、E、F、G 是短周期元素,周期表中 B 与 C 相邻,C 与 E 同主族; A 中 L 层是 K 层的 2 倍,B 的电子数比 C 的电子数少 1 个;F 元素的原子在周期表中半径最小;常见化合物 D2C2 与水反应生成 C 的气体单质,且完全反应后的溶液能使酚酞溶液变红。G 是第三周期原子半径最小的主族元素。
(1)A 在元素周期表中的位置_________________ 。
(2) D2C2 的电子式为________ , 属于________________化合物(填“离子”或“共价”)。
(3)C 与 F 元素可形成 18 电子分子的电子式为 。
(4)A、B、C 的氢化物稳定性顺序为____________________(用分子式表示); G 的阴离子的还原性比 E 的阴离子的还原性 ___________________________(填“强”或“弱”)。
(5)F2C 和 F2E 中,沸点较高的是________(填化学式),其主要原因是 _____________。
(6)锡(Sn)与 A 同主族,常温下能和浓硫酸反应,生成 Sn(SO4)2 和刺激性气味气体, 反应的化学方程式为 __________________________________。
【答案】第二周期第ⅣA族 Na+ ![]() Na+ 离子 H2O>NH3>CH4 弱 H2O H2O分子间存在氢键 Sn+ 4H2SO4(浓)=Sn(SO4)2+4H2O+ 2SO2↑
Na+ 离子 H2O>NH3>CH4 弱 H2O H2O分子间存在氢键 Sn+ 4H2SO4(浓)=Sn(SO4)2+4H2O+ 2SO2↑
【解析】
A中L层(第二层)是K层(第一层)的2倍,A为碳;F 元素的原子在周期表中半径最小,F为氢;常见化合物 D2C2 与水反应生成 C 的气体单质,且完全反应后的溶液能使酚酞溶液变红,C为氧,D为钠;C 与 E 同主族,E为硫;B 的电子数比 C 的电子数少 1 个,B为氮;G 是第三周期原子半径最小的主族元素,G为氯。
(1)据分析,A 在元素周期表中的位置为第二周期第ⅣA族;
(2)Na2O2电子式为Na+ ![]() Na+,含有离子键和共价键,故属于离子化合物;
Na+,含有离子键和共价键,故属于离子化合物;
(3)氧元素和氢元素形成18电子的物质是过氧化氢H2O2,电子式![]() ;
;
(4)氢化物的稳定性与非金属性呈正比,非金属性:O>N>C,故氢化物稳定性顺序为H2O>NH3>CH4;非金属阴离子的还原性与非金属性呈反比,非金属性Cl>S,Cl-的还原性比 S2-还原性弱;
(5) H2O分子间存在氢键,熔沸点比同主族简单氢化物的显著高,故H2O和H2S比较,熔沸点较高的是H2O;
(6)锡和碳为同一主族,化学性质具有相似性和递变性,因此Sn常温下能和浓硫酸反应,生成Sn(SO4)2和刺激性气味气体二氧化硫, 反应的化学方程式为Sn+ 4H2SO4(浓)=Sn(SO4)2+4H2O+ 2SO2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,水浴加热后未出现银镜 | 蔗糖未水解 |
B | 卤代烃Y与NaOH乙醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 说明卤代烃Y中含有氯原子 |
C | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清且无气体产生 | 说明苯酚的酸性强于碳酸 |
D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟喹诺酮是人工合成的抗菌药,其中间体G的合成路线如下:
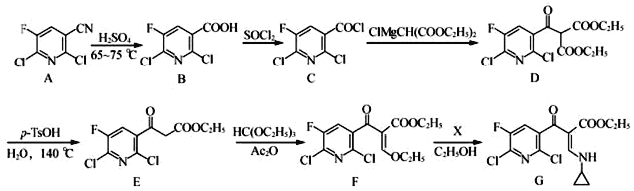
(1)G中的含氧官能团为_____和_____(填名称)。
(2)由C→D的反应类型是_____。
(3)化合物X(分子式为C3H7N)的结构简式为_____。
(4)E到F过程中的反应物HC(OC2H5)3中最多有_____个碳原子共面。
(5)B和乙醇反应的产物为H(C8H6FCl2NO2),写出该反应的化学方程式_______________ 。
写出满足下列条件的H的所有同分异构体的结构简式:_____________。
Ⅰ.是一种α﹣氨基酸;
Ⅱ.分子中有4种不同化学环境的氢,且分子中含有一个苯环。
(6)根据已有知识并结合相关信息,写出以 ![]() 和ClMgCH(COOC2H5)2为原料制备
和ClMgCH(COOC2H5)2为原料制备 的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)_____________。
的合成路线流程图(无机试剂任选,合成路线流程图示例见本题题干)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种常见的非金属单质,B是氧化物,E是A的氢化物,D是A的最高价氧化物对应的水化物,上述物质间转化关系如图所示。下列说法错误的是 ( )

A. 若E、D的水溶液均呈酸性,则A为硫
B. 若D是一种难溶于水的物质,则A为硅
C. 若E、D的水溶液均呈酸性,则B能与水反应
D. 若D是一种难溶于水的物质,则B能与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含如下离子组中的几种![]()
![]()
![]()
![]() ,某同学欲探究该溶液的组成进行了如下实验:
,某同学欲探究该溶液的组成进行了如下实验:
Ⅰ.用铂丝醮取少量溶液,在火焰上灼烧,透过蓝色钴玻璃,观察到紫色火焰
Ⅱ.另取原溶液加入足量盐酸有无色气体生成,此时溶液颜色加深,但无沉淀生成
Ⅲ.取Ⅱ反应后溶液分别置于两支试管中,第一支试管中加入 BaCl2 溶液有白色沉淀生成, 再滴加 KSCN 溶液,上层清液变红,第二支试管加入 CCl4,充分振荡静置后溶液分层,下层为无色。
下列说法正确的是( )
A.原溶液中肯定不含 ![]()
B.原溶液中肯定含有 ![]()
C.步骤Ⅱ中无色气体是 NO 气体,无 CO2 气体产生
D.为确定是否含有 Cl-可取原溶液加入过量硝酸银溶液,观察是否产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种碳纳米管能够吸附氢气,用这种材料制备的电池其原理如下图所示,该电池的电解质为6 mol·L-1KOH溶液。下列说法中不正确的是( )

A.放电时电池负极的电极反应为H2-2e-+2OH-=2H2O
B.放电时K+移向正极
C.放电时镍电极的电极反应为Ni(OH)2+OH--e-=NiO(OH)+H2O
D.该反应过程中KOH溶液的浓度基本保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3X(g)+Y(g) ![]() Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入X:______________;
(5)加入Y:______________;
(6)压缩体积:______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是

A.Q位于第三周期ⅠA族
B.Z与M的氧化物对应水化物均为强酸
C.简单离子半径:M>R2+>Q+
D.X、Y、Z三种元素组成的化合物可能含有离子键和共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此废玻璃为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。

己知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)废玻璃在NaOH溶液浸洗前往往要进行的操作________,反应①的离子方程式_______。
(2)反应②的离子方程武是____________。
(3)为了得到较纯的Ce3+溶液,反应②之前要进行的操作是______。
(4)反应③需要加入的试剂X可以是_________。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
![]()
用FeSO4溶液滴定用_____做指示剂,滴定终点的现象_______若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com