
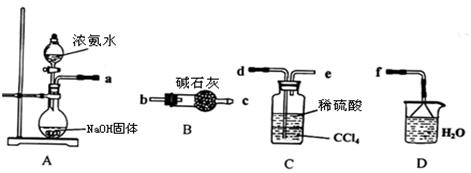
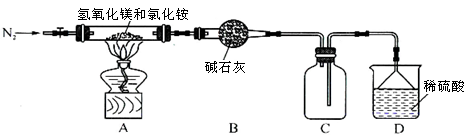
 NH4++OH�����ƣ����������ݳ���(2��)
NH4++OH�����ƣ����������ݳ���(2��) MgOHCl+NH3��+H2O(2��)
MgOHCl+NH3��+H2O(2��)  NH4++OH������NaOH��Ϻ�NaOH�����OH������ʹ��ˮ����ƽ�������ƶ������������ݳ���
NH4++OH������NaOH��Ϻ�NaOH�����OH������ʹ��ˮ����ƽ�������ƶ������������ݳ��� MgOHCl+NH3��+H2O��
MgOHCl+NH3��+H2O��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 I3��(aq)���ڷ�Ӧ��ƽ����ϵ�У�c(I3��)���¶�T�Ĺ�ϵ��ͼ��ʾ�������ϵ��κ�һ�㶼��ʾƽ��״̬����
I3��(aq)���ڷ�Ӧ��ƽ����ϵ�У�c(I3��)���¶�T�Ĺ�ϵ��ͼ��ʾ�������ϵ��κ�һ�㶼��ʾƽ��״̬����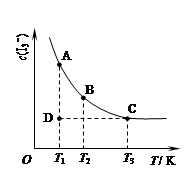
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2SO3(g)��ij�¶��£���2mol SO2��1mol O2����10L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����
2SO3(g)��ij�¶��£���2mol SO2��1mol O2����10L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת����(��)����ϵ��ѹǿ(p)�Ĺ�ϵ��ͼ����ʾ��������˵����ȷ����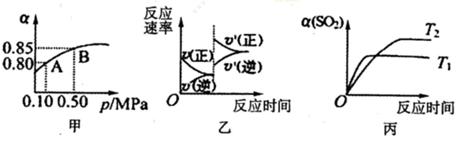
| A����ͼ���ƶϣ�B��SO2��ƽ��Ũ��Ϊ0.3mol��L-1 |
| B����ͼ���ƶϣ�A���Ӧ�¶��µ�ƽ�ⳣ��Ϊ80 |
| C����ƽ�����С�����ݻ�����Ӧ���ʱ仯ͼ�������ͼ�ұ�ʾ |
| D��ѹǿΪ0.50 MPaʱ��ͬ�¶���SO2ת�������¶ȹ�ϵ���ͼ�����H<0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
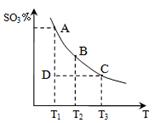
 2SO3(g)�ġ�H____0(�>����<��)�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�������������ҡ����ƶ�������
2SO3(g)�ġ�H____0(�>����<��)�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�������������ҡ����ƶ������� 2CO2��N2�������ŵ��� ��
2CO2��N2�������ŵ��� ��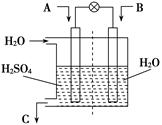
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3��g������H=��92.4 kJ��mol��1����������ȷ����
2NH3��g������H=��92.4 kJ��mol��1����������ȷ����| A���ﵽ��ѧƽ��ʱ���������¶ȣ�������Ӧ���ʼ�С���淴Ӧ�������� |
| B������λʱ��������x mol N2��ͬʱ����2x mol NH3����Ӧ�ﵽƽ��״̬ |
| C���ﵽƽ������������СΪԭ����һ�룬���´ﵽƽ���c��NH3����Ϊԭƽ��ʱ��2�� |
| D�����ﵽƽ��ʱ�����ų�46.2kJ����������l mo1NH3��g������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2(g)��H2(g)�����������ݣ�
CO2(g)��H2(g)�����������ݣ�| ʵ�� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | |||
| CO | H2O | CO2 | H2 | CO2 | ||
| 1 | 650 | 2.0 | 1.0 | 0 | 0 | 0.8 |
| 2 | 800 | 2.0 | 2.0 | 0 | 0 | 1.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HI(g) ��H =" -14.9" kJ/mol��ʵ��ʱ�й��������±���
2HI(g) ��H =" -14.9" kJ/mol��ʵ��ʱ�й��������±���
| A��ƽ��ʱ��������ɫ���a>0.008 |
| B��ƽ��ʱ���ų���������Q1=1/2Q2 =0.149kJ |
| C�����¶��£��÷�Ӧ��ƽ�ⳣ��K="4" |
| D��ƽ���������ٳ���0.004 mol HI���壬�ٴδﵽƽ��ʱHI�İٷֺ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C(g)+D(g)�Ѵ�ƽ����ǣ� ��
C(g)+D(g)�Ѵ�ƽ����ǣ� ��| A����������ѹǿ | B�����������ܶ� |
| C��B�����ʵ���Ũ�� | D����������ƽ����Է������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 Ni(CO)4��g������֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ�±�������˵����ȷ����
Ni(CO)4��g������֪�÷�Ӧƽ�ⳣ�����¶ȵĹ�ϵ�±�������˵����ȷ����| �¶ȡ� | 25 | 80 | 230 |
| ƽ�ⳣ�� | 5��104 | 2 | 1.9��10-5 |
 Ni��s��+4CO��g����ƽ�ⳣ��Ϊ0.5
Ni��s��+4CO��g����ƽ�ⳣ��Ϊ0.5�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com