
【题目】实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2 , 实验装置如图所示:回答下列问题: 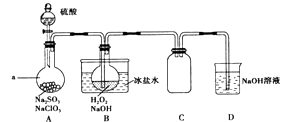
(1)仪器a的名称为;装置C的作用是 .
(2)该实验必须使NaClO3稍微过量,目的是 .
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 .
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 则另一种为 .
(5)B中反应的离子方程式为 .
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入(填序号,下同)酸化,再加入检验. ①稀HNO3②稀H2SO4③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9g NaClO23H2O(相对质量:144.5),至少需g NaClO3(相对质量:106.5).
【答案】
(1)分液漏斗;防止倒吸
(2)使Na2SO3完全反应,避免产生SO2
(3)控制硫酸滴入速度
(4)ClO3﹣
(5)2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2↑
(6)②;⑤⑥
(7)26.6
【解析】解:实验过程分析:装置A中盛放硫酸、NaClO3和Na2SO3 , 反应生成ClO2气体:2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O,ClO2气体和H2O2在B发生发生氧化还原反应:2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2 , 发生反应可能使装置内压强降低,可能发生倒吸,装置C为防倒吸装置,装置D为尾气吸收装置;(1)根据图示可知仪器a为分液漏斗;亚硫酸钠具有还原性,在反应中作还原剂;装置A中产生ClO2的反应是氯酸钠在酸性溶液中氧化亚硫酸钠为硫酸钠,本身被还原为二氧化氯,ClO2进入装置B,发生反应使装置内压强降低,可能发生倒吸,装置C的作用为防止倒吸;所以答案是:分液漏斗;防止倒吸;(2)根据反应方程式可知使一种反应物过量,则另一种反应物反应完全,所以该实验必须使NaClO3稍微过量,目的是使Na2SO3完全反应,避免产生SO2 , 所以答案是:使Na2SO3完全反应,避免产生SO2;(3)缓慢通入ClO2 , 可以使ClO2气体被均匀、充分吸收,ClO2是硫酸、NaClO3与亚硫酸钠反应生成的,所以要使ClO2气体能被均匀、充分吸收,应该控制控制硫酸滴入速度;所以答案是:控制硫酸滴入速度;(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 氧化还原反应规律,另一种离子中Cl元素化合价升高,即为ClO3﹣;所以答案是:ClO3﹣;(5)B中发生反应为二氧化氯在碱性溶液中和过氧化氢发生氧化还原反应制得NaClO2 , 二氧化氯中Cl为+4价,变为NaClO2中的+3价,化合价变低,过氧化氢中的元素化合价应该升高,则H2O2中O元素化合价由﹣2价变为0价,产物为O2和H2O,反应的离子方程式为:2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2↑,所以答案是:2ClO2+2OH﹣+H2O2=2ClO2﹣+2H2O+O2↑;(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入非氧化性酸酸化,再加入含Fe2+的化合物,若有Fe3+生成,则证明NaClO2具有氧化性,用KSCN溶液检验Fe3+ , 现象是溶液变红;所以答案是:②;⑤⑥;(6)NaClO2具有氧化性,能将亚铁离子氧化为铁离子,用硫氰化钾检验铁离子即可,但是硝酸具有氧化性,会将亚铁离子氧化,所以用硫酸酸化但是不用硝酸酸化,所以答案是:②;⑤⑥;(7)28.9 g NaClO23H2O(式量:144.5),n(NaClO23H2O)= ![]() =
= ![]() =0.2mol,根据氯原子守恒知:n(NaClO3)=n(NaClO23H2O)=0.2mol,m(NaClO3)=n(NaClO3)M(NaClO3)=0.2mol×106.5g/mol=21.3g;NaClO3转化为NaClO2的转化率为80%,需所要NaClO3的质量为:
=0.2mol,根据氯原子守恒知:n(NaClO3)=n(NaClO23H2O)=0.2mol,m(NaClO3)=n(NaClO3)M(NaClO3)=0.2mol×106.5g/mol=21.3g;NaClO3转化为NaClO2的转化率为80%,需所要NaClO3的质量为: ![]() ≈26.6g,所以答案是:26.6.
≈26.6g,所以答案是:26.6.


科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去). 
已知:①2NO+Na2O2═2NaNO2;
②NO能被酸性KMnO4氧化成NO3﹣ , MnO4﹣被还原为Mn2+ .
(1)制备NaNO2
(i)装置A三颈烧瓶中发生反应的化学方程式为 .
(ii)B装置的目的是 .
(iii)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是(填序号).
A.P2O5 B.碱石灰 C.无水CaCl2 D.生石灰
(iv)E装置发生反应的离子方程式是 .
(2)测定NaNO2纯度
准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解.用a molL﹣1酸性KMnO4溶液滴定,达滴定终点时所用KMnO4溶液体积为bml.则样品中NaNO2的质量分数为 .
(假设样品中其他杂质与酸性KMnO4溶液不反应,用含m、a、b的代数式表示.)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物YX2、ZX2中,X、Y、Z的核电荷数小于18;X原子最外能层的p能级中有一个轨道充填了2个电子,Y原子的最外层中p能级的电子数等于前一能层电子总数,且X和Y具有相同的电子层;Z与X在周期表中位于同一主族.回答下列问题:
(1)X的电子排布式为 , Y的电子排布图为;
(2)ZX2的分子式是 , YX2电子式是;
(3)Y与Z形成的化合物的分子式是 , 该化合物中化学键的种类是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的叙述正确的是( )
A.任何物质中都含有化学键B.共价化合物中可能含有离子键
C.离子化合物中只含离子键D.离子化合物中可能含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物用途非常广泛,目前世界上60%的镁是从海水中提取.从海水中先将海水淡化获得淡水和浓海水,浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl﹣ | SO42﹣ |
浓度/(gL﹣1) | 63.7 | 28.8 | 144.6 | 46.4 |
再利用浓海水提镁的一段工艺流程如下图:
请回答下列问题
(1)浓海水主要含有的四种离子中物质的量浓度最小的是 . 在上述流程中,可以循环使用的物质是 .
(2)在该工艺过程中,X试剂的化学式为 .
(3)“一段脱水”目的是制备MgCl22H2O;“二段脱水”的目的是制备电解原料.若将MgCl26H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为 .
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为g.
(5)以LiCl﹣KCl共熔盐为电解质的Mg﹣V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl MgCl2+V2O4Li2O 该电池的正极反应式为 .
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则: Mg(s)+2B(s) MgB2(s)△H= . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用NaClO3制取ClO2气体,再由ClO2制得NaClO2 , 实验装置如图所示:回答下列问题: 
(1)仪器a的名称为;装置C的作用是 .
(2)该实验必须使NaClO3稍微过量,目的是 .
(3)为使ClO2气体能被均匀、充分吸收,操作时应注意 .
(4)NaOH吸收ClO2尾气,生成物质的量之比为1:1的两种阴离子,一种为ClO2﹣ , 则另一种为 .
(5)B中反应的离子方程式为 .
(6)证明NaClO2具有氧化性的方法是:将B中溶液加热除去H2O2 , 加入(填序号,下同)酸化,再加入检验. ①稀HNO3②稀H2SO4③K2SO3溶液 ④BaCl2溶液 ⑤FeCl2溶液 ⑥KSCN溶液
(7)预计NaClO3转化为NaClO2的转化率为80%,若要制得28.9g NaClO23H2O(相对质量:144.5),至少需g NaClO3(相对质量:106.5).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础](15分) 氟他胺G是一种可用于治疗肿瘤的药物。实验室由芳香烃A制备G的合成路线如下:
回答下列问题:
(1)A的结构简式为。C的化学名称是。
(2)③的反应试剂和反应条件分别是 , 该反应的类型是。
(3)⑤的反应方程式为。吡啶是一种有机碱,其作用是。
(4)G的分子式为。
(5)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有种。
(6)4-甲氧基乙酰苯胺( ![]() )是重要的精细化工中间体,写出由苯甲醚(
)是重要的精细化工中间体,写出由苯甲醚( ![]() )制备4-甲氧基乙酰苯胺的合成路线(其他试剂任选)。
)制备4-甲氧基乙酰苯胺的合成路线(其他试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com