
【题目】恒容密闭容器中发生反应:2NO2(g)![]() 2NO(g)+O2(g)(NO2红棕色气体,NO无色气体),下列状态中不能表明该反应达到平衡状态的有( )
2NO(g)+O2(g)(NO2红棕色气体,NO无色气体),下列状态中不能表明该反应达到平衡状态的有( )
A.混合气体的颜色不再改变的状态
B.单位时间内生成nmolO2的同时生成2nmolNO2
C.混合气体的密度不再改变的状态
D.混合气体的平均相对分子质量不再改变
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、Q是原子序数依次增大的前四周期元素,W是宇宙中最丰富的元素;X、Z元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有2个未成对电子;向含有 QSO4的溶液中滴加氨水,生成蓝色沉淀,继续滴加氨水,沉淀溶解,得深蓝色溶液。请回答下列问题:
(1)Y元素在周期表中的位置为___________, Z原子的价电子排布图为___________________
(2)W可分别与X、Y形成多种化合物,其中,最简单化合物的稳定性由强到弱的顺序为_____(用分子式表示);Y的一种氢化物能在卫星发射时作燃料,写出该氢化物的结构式_______________。
(3)继续滴加氨水,沉淀溶解时反应:____________________________(用离子方程式表示),向深蓝色溶液中再加乙醇,会析出深蓝色的[Q(NH3)4]SO4·H2O晶体,该晶体中含有的化学键____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学为了探究铜与浓硫酸的反应,进行了一系列实验。在反应过程中会发生一些副反应,生成不溶于水和酸的CuS、Cu2S。
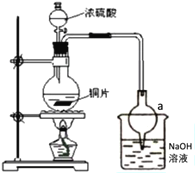
(1)处于安全和绿色化学考虑,在制取硫酸铜时,可选用下列的物质是____。
a.Cu b.CuO c.CuS d.CuSO4·Cu(OH)2H2O
(2)装置a的作用是___。反应过程中,因为浓硫酸的吸水作用,烧瓶中出现白色固体物质,如何简便检验反应后圆底烧瓶里有Cu2+存在?___。在实际反应中,由于条件控制不好,容易产生CuS和Cu2S固体:2CuS![]() Cu2S+S。
Cu2S+S。
(3)已知样品质量为ag,得到Cu2S是bg,则样品中CuS质量分数是___。如果Cu2S高温下转化为Cu,则实验测得的值会___(填“偏大”、“偏小”或“不变”)
(4)根据以上信息,说明铜与浓硫酸反应需要控制哪些条件?___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如图所示。该物质具有下列的结构和性质,不正确的是( )
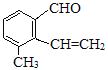
A.最多可以和5molH2发生加成反应
B.所有原子有可能在同一平面内
C.能与Br2在光照下发生取代
D.能与Ag(NH3)2OH溶液发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用KSCN溶液和FeCl2溶液探究Fe2+的还原性时出现异常现象,实验如下:
① | ② | ③ |
|
|
|
溶液变红,约10秒后红色褪去,产生能使带火星木条复燃的气体,取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀 | 溶液变红且不褪色,有能使带火星木条复燃的气体产生,产物经检验有丁达尔效应 | 溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,产物经检验无丁达尔效应 |
下列说法错误的是
A.②中红色溶液中含有Fe(OH)3胶体
B.实验②中发生的氧化还原反应只有两种
C.对比①②,可以判定酸性条件下H2O2可以氧化SCN-
D.③中发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
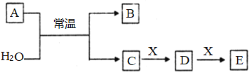
(1)若A为常见的金属单质,且其焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为__________(填字母)。
a. NaHCO3 b. Na2CO3 c.Al(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为_______ 。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为___。(填字母)
a.盐酸 b.CaCl2溶液 c.氨水 d.澄清石灰水
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与水反应的化学方程式中氧化剂与还原剂的物质的量之比为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用生产钛白的副产品FeSO4与软锰矿(主要成分是MnO2)可制备高纯MnO2
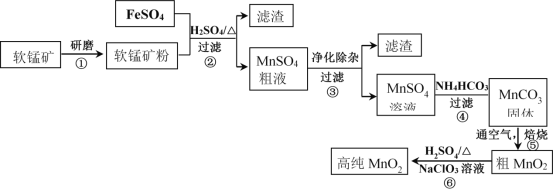
(1)步骤①中研磨的目的是______________________。
(2)步骤②中主要发生的反应是FeSO4与MnO2转化为MnSO4与__________。
(3)步骤②中Mn2+浸出率受初始H2SO4浓度与温度的影响如下图所示。
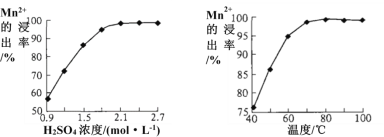
软锰矿粉酸浸的适宜条件是________________。
(4)步骤②中,若硫酸初始浓度小于1.8mol/L,反应进行一段时间后,有红褐色固体析出,其原因是____________。
(5)已知MnSO4粗液中还含有Al3+、Fe3+和Ni2+离子,溶液中离子生成氢氧化物的pH如下表:
Al(OH)3 | Fe(OH)3 | Ni(OH)2 | Mn(OH)2 | |
开始沉淀时pH | 3.4 | 1.5 | 6.9 | 8.2 |
完全沉淀时pH | 4.7 | 2.8 | 8.9 | 10.2 |
注:金属离子的起始浓度为0.1mol·L-1
步骤③进行的操作是:调节pH=5.4,过滤,滤渣中含_____________________。
(6)已知:几种难溶物的溶解平衡常数K
化学式 | MnCO3 | NiCO3 | MnS | NiS |
K | 2.24×10-11 | 1.42×10-7 | 4.65×10-14 | 1.07×10-21 |
步骤③还需加入的除杂试剂是_______固体(填序号)。
A.Na2CO3 B.MnCO3 C.Na2S D.MnS
(7)步骤⑤中焙烧MnCO3制MnO2,发生反应的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃 A 是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平, A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型。根据图回答下列问题:

(1)物质D有特殊香味,生活中常用于饮料、燃料、消毒,D的名称为________,含有的官能团为________。
(2)写出②、④两步反应的化学方程式,并注明反应类型:
②______________________,反应类型__________。
④______________________,反应类型_________。
(3)图中由A制备C的最好途径是通过反应_______(填写“②”或“①⑤”):理由是:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com