
| A、钠与水反应 |
| B、氧化钠与水反应 |
| C、过氧化钠与水反应 |
| D、二氧化硫与水反应 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
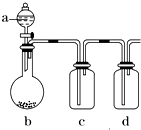 有几个实验小组的同学,利用如图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.
有几个实验小组的同学,利用如图装置进行“一器多用”的实验探究(a中盛放的液体均匀慢速滴下;b中盛放的药品足量;若在c、d中盛装液体,则长导管均浸入液面以下),每组同学设想在a、b、c、d中分别盛放不同物质,来制取某种气体并检验其性质.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v (A)=0.3 mol?L-1?min-1 |
| B、v (B)=0.6 mol?L-1?min-1 |
| C、v (C)=0.5 mol?L-1?min-1 |
| D、v (A)=0.01 mol?L-1?s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性 | B、还原性 |
| C、碱性 | D、酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
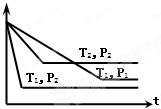 已知某可逆反应:mA(g)+nB(g)?xC(g),在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是( )
已知某可逆反应:mA(g)+nB(g)?xC(g),在密闭容器中进行,右图表示反应在不同时间t、温度T和压强P与C在混合气体中的百分含量(C%)的关系曲线,则正确的是( )| A、T1>T2,P1>P2,m+n>x,正反应放热 |
| B、T1<T2,P1<P2,m+n<x,正反应吸热 |
| C、T1>T2,P1<P2,m+n<x,正反应放热 |
| D、T1<T2,P1>P2,m+n>x,正反应吸热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942KJ,根据以上信息和数据,下列说法正确的是( )
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942KJ,根据以上信息和数据,下列说法正确的是( )| A、N4属于一种新型的化合物 |
| B、N4与N2互为同位素 |
| C、N4与N2互为同素异形体 |
| D、1mol N4气体转变为N2将吸收882kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
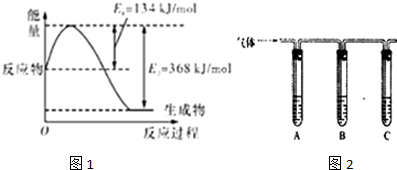
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 试管B中加1%品红溶液; 试管C中加 | 若 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,1mol水的体积是22.4L |
| B、1molH2所占的体积一定是22.4L |
| C、在标准状况下,NA个任何分子所占的体积约为22.4L |
| D、在标准状况下,28g的N2体积约为22.4L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com