
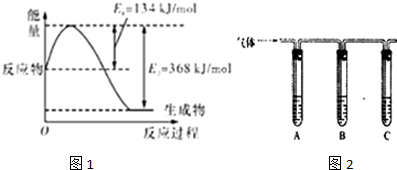
| 所加试剂 | 预期现象和结论 |
| 试管A中加足量 试管B中加1%品红溶液; 试管C中加 | 若 |
| ③; ⑤ | A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊 |
| 2bv2×0.001 |
| 5 |
| 2bv2×0.001 |
| 5 |
aV1-
| ||
| 25 |
aV1-
| ||
| 25 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、氯乙烷与浓硫酸混和加热到170℃可发生消去反应生成乙烯 |
| B、苯与浓硝酸、浓硫酸的混和物加热到100~110℃时,因浓硝酸挥发和分解而得不到硝化产物 |
| C、将苯酚、40%的甲醛溶液和少量浓盐酸混和,水浴加热数分钟即可生成酚醛树脂 |
| D、酯化反应通常需要在浓硫酸存在下进行,浓硫酸此时既是催化剂又是吸水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O2和O3 |
| B、CH2=CHCH2CH3和CH3CH=CHCH3 |
| C、CH3CH2CH3和CH3(CH2)2CH3 |
| D、乙醇和乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:
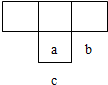 短周期元素a、b、c在周期表中位置如图所示,已知三者原子序数之和为27,则a、b、C三种元素的名称是( )
短周期元素a、b、c在周期表中位置如图所示,已知三者原子序数之和为27,则a、b、C三种元素的名称是( )| A、碳、氮、硅 |
| B、氮、氧、磷 |
| C、硼、碳、铝 |
| D、氧、氟、硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、《京都议定书》针对六种温室气体进行削减,包括二氧化碳(CO2)、甲烷(CH4)、氧化亚氮(N2O)、氢氟碳化物(HFCs)、全氟碳化物(PFCs)及六氟化硫(SF6).科学研究发现,同条件下等体积的甲烷产生的温室效应远远强于二氧化碳的.那么等质量的二氧化碳产生温室效应比甲烷的强 |
| B、合成高学科王效、稳定、廉价的太阳能光电转化材料,是开发利用太阳能的关键 |
| C、稀土元素都是长周期元素,稀土资源是国家战略性资源 |
| D、环境问题的最终解决要依靠科技进步,通常利用沉淀反应除去污水中的重金属离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
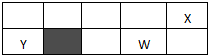 已知:X、Y、Z、W为短周期元素,原子半径X:99pm Y:154pm Z:125pm W:117pm,X、Y、W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是( )
已知:X、Y、Z、W为短周期元素,原子半径X:99pm Y:154pm Z:125pm W:117pm,X、Y、W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是( )| A、元素Z处于周期表的阴影位置 |
| B、X与W形成的化合物熔点很高,为离子化合物 |
| C、X、W的最高价氧化物对应水化物的酸性:X>W |
| D、Y、W的最高价氧化物的晶体类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
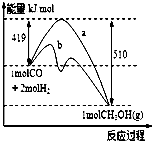 工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g)
工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g)| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com