
【题目】为了使AlCl3溶液中的Al3+离子尽可能全部转化为Al(OH)3沉淀,最合适的试剂是( )
A.NaOH溶液
B.KOH溶液
C.盐酸
D.氨水
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一条鱼虾几乎绝迹的小河边从上游到下游依次有四座工厂——甲、乙、丙、丁,它们排出的废液里,每厂只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍清。 请完成下列各题:
请完成下列各题:
(1)四座工厂排出的废液里含有的污染物是:
甲__________乙__________丙___________丁_____________。(填化学式)
(2)在丁的下游M处取出的河水中,肯定含有的离子是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp[AgCl]=1.8×10-10,Ksp[AgBr]=4.9× 10-13,Ksp[AgI]=1.0×10-16,Ksp[Ag2S]=1.6×10-49。则除去NaNO3溶液中混有的AgNO3,所用下列试剂中效果最好的是
A. NaC1溶液 B. NaBr 溶液 C. NaI溶液 D. Na2S溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蒸馏是实验室制备蒸馏水的常用方法,如图所示的两个装置都可以制取蒸馏水。

(1)图Ⅰ是实验室制取蒸馏水的常用装置,仪器A、B、C的名称分别是_________、________、_______。加热A时要加垫石棉网,目的是_________________________________。
(2)图Ⅰ中冷凝水的流向是否正确?____(填“正确”或“不正确”),理由是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量____,其作用是____________。
(4)图Ⅱ装置也可用于少量蒸馏水的制取(加热及固定仪器略),其原理与图Ⅰ完全相同。该装置中使用的玻璃导管较长,其作用是_______________;烧杯中还应盛有的物质是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的的是
A | B | C | D | |
实验目的 | 比较盐酸、碳酸、硅酸的酸性强弱 | 检验碳与浓H2SO4反应的产物中含CO2 | 验证铁的析氢腐蚀 | 模拟电解精炼铜 |
实验装置 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组的同学对一粗盐样品进行初步提纯。所用实验仪器或用品如下

(1)D的名称是__________。
(2)提纯的步骤是:溶解、过滤、__________。
(3)“过滤”操作的要点可概括为“一贴、二低、三靠”,其中的“二低”是__________、__________。
(4)该实验中多次利用仪器B__________(填名称)和仪器__________(填字母序号),且该仪器使用了__________次。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘是人体必需的微量元素,在医药和工业中都有广泛用途,因此从含碘废液中回收碘充分利用二次资源是非常重要的。实验室从含碘废液(除H2O外,含有CCl4、I2、I-)中回收碘,其实验过程如图1:(己知氧化性Cl2> IO3-)
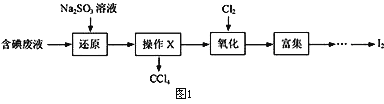
(1)向含碘废液中加入稍过量的Na2SO3溶液,反应的离子方程式为_________,该操作将I2还原为I-的目的是_________________________________________;
(2)操作X的名称为______________________________________;
(3)氧化时,在三颈烧瓶中将含I-的水溶液用盐酸调至pH约为2,通入Cl2,在40℃左右反应(实验装置如图2所示)。下列有关说法正确的是_____(填字母)。
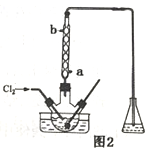
a.在实验中要缓慢通入氯气。提高氯气的利用率,防止产生污染
b.控制在较低温度下进行的主要原因是增大氯气的溶解度
c.通入过量的氯气可提高碘的产量
d.为有效防止碘的挥发水应从b口通入
e.锥形瓶中应盛放NaOH溶液
(4)二氧化氯(C1O2,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用C1O2氧化酸性含I-废液回收碘。
①写出C1O2氧化I-的离子方程式____________________________________。
②若处理含I-相同量的废液回收碘、所需Cl2的物质的量是C1O2的______________倍。
(5)已知:5SO32-+2IO3-+2H+![]() I2+5SO42-+H2O。某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
I2+5SO42-+H2O。某含碘废水(pH约为8)中一定存在I2,可能存在I-、IO3-中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案:(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)
①取适量含碘废水用CCl4多次萃取、分液,直到水层检验不出碘单质存在;
②_______________________;
③另从水层取少量溶液,加入2-3滴淀粉溶液,滴加________________(填试剂和现象)。说明废水中含有IO3-,否则说明废水中不含IO3-。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白:
(1)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为____________。
(2)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为__________。
(3)标准状况下,密度为0.75 g·L-1的NH3与CH4组成的混合气体中,NH3的体积分数为__________,该混合气体对氢气的相对密度为________。
(4)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为__________________。
(5)同温同压下,已知O2的密度为ρg/L,则CO2的密度为__________。
(6)现有下列三种气体:①32 g CH4;②约含有6.02×1023个HCl分子的氯化氢气体;③标准状况下33.6 LO2。请按物理量由小到大的顺序排列:a.质量________(填序号,下同);b.分子数目________c.相同状况下气体的体积________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列有关判断不正确的是 ( )

A. 该温度下,Ksp(MnS)大于1.0×10-35
B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀
C. 向c(Fe2+)=0.1mol·L-1的溶液中加入CuS粉末,有FeS沉淀析出
D. 该温度下,溶解度:CuS>MnS>FeS>ZnS
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com