
化学与生活息息相关,下列说法正确的是
| A.蔗糖、钡餐(硫酸钡)和水分别属于弱电解质、强电解质和非电解质 |
| B.淀粉、油脂和蛋白质都是高分子化合物 |
| C.用食醋可除去热水壶内壁的水垢 |
| D.光导纤维是将太阳能转化为电能的常用材料 |
C
解析试题分析:蔗糖是多羟基醛,不能电离,属于非电解质,水能微弱地电离,属于弱电解质,硫酸钡是难溶于水的盐,但溶解部分完全电离,属于强电解质,故A项错误;油脂是甘油三酯,不属于高分子化合物,淀粉和蛋白质属于高分子化合物,故B项错误;水垢的主要成分是碳酸钙,食醋的主要成分是乙酸,乙酸的酸性比碳酸强,乙酸与碳酸钙能发生复分解反应,生成乙酸钙、水和二氧化碳,乙酸钙是可溶性盐,故C项正确;单质硅是将太阳能转化为电能的常用材料,二氧化硅是光导纤维的主要成分,用于通讯等,故D项错误。
考点:考查STSE,涉及强电解质、弱电解质、非电解质、高分子化合物等基本概念,以及食醋除水垢的原理、光导纤维和单质硅的用途等。


科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.高纯度的硅单质广泛用于制作光导纤维 |
| B.化工生产时将氯气通入到饱和的石灰水中可制得大量漂粉精 |
| C.SO2被氧气氧化的条件一般选择高温、高压、催化剂 |
| D.矿青石棉的化学式为:Na2Fe5Si8O22(OH)2改写成氧化物的形式则为Na2O·3FeO·Fe2O3·8SiO2·H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学在生产和日常生活中有着重要的应用。下列说法不正确是
| A.常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| B.高纯度的硅单质广泛用于制作光导纤维 |
| C.二氧化氯具有氧化性,可用于白来水的杀菌消毒 |
| D.在海轮外壳上镶人锌块,可减缓船体的腐蚀速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学与材料、生活和环境密切相关。下列有关说法中错误的是
| A.新型材料聚酯纤维、光导纤维都属于有机高分子 |
| B.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 |
| C.大力实施矿物燃料脱硫脱硝技术以减少硫、氮氧化物排放 |
| D.煤炭经气化、液化和干馏等过程,可获得清洁能源和重要的化工原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是
| A.为了提高生活用水的卫生标准,自来水厂常同时使用Cl2和FeSO4·7H2O进行消毒、净化,以改善水质 |
| B.铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等 |
C.从分类的角度看,混合物、分散系、胶体的从属关系如图所示: |
| D.借助扫描隧道显微镜,应用STM技术可实现对原子或分子的操纵 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
材料是人类赖以生存和发展的重要物质基础,划时代的材料可作为人类文明的里程碑。
(1)玻璃是传统硅酸盐材料,普通玻璃是由石英砂、纯碱和________(写名称)高温熔融而制成的,主要反应的化学方程式为__________________________________________、__________________________________。
(2)氮化硅是一种新型结构陶瓷,具有熔点高、硬度大、化学性质稳定等优良性能。它的一种制备方法为硅的氯化物与氨气加热,生成化合物Si(NH2)4和HCl气体;Si(NH2)4在高温下分解生成了该陶瓷。写出相关反应的化学方程式:__________________________、______________________________。
(3)以化学为核心的科学技术,制造了无数比天然高分子材料性能优异的产品,甚至设计和创造了自然界原来没有的新物质,合成有机高分子材料就是其中的典型代表。
①工程塑料PBT的结构如下图所示,下列关于PBT的说法中,正确的是________。
A.PBT是通过加聚反应得到的高分子化合物
B.PBT中含有羧基、羟基和酯基
C.PBT的单体中有芳香烃
D.PBT的单体均能与Na、NaOH、Na2CO3反应
E.生成1 mol PBT的同时会生成(2n-1)mol H2O
②下列处理废旧热固性塑料的做法不可取的是________。
A.深埋 B.粉碎后用作树脂填料
C.用作燃料 D.用有机溶剂将其溶解、回收
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电石是重要的工业原料,电石渣[主要成分Ca(OH)2]的综合利用体现了绿色化学思想。
(1)用电石为原料可生产聚氯乙烯。聚氯乙烯的结构简式为____________。
(2)电石渣可用于除去垃圾焚烧炉烟道气中的SO2生成CaSO4,反应中的氧化剂是____________ (填名称)。
(3)电石渣可用于生产纯碱。涉及的部分化学反应为:
(i)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
(ii)2NH4Cl+Ca(OH)2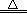 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
此生产过程中,可循环利用的物质有____________ (填化学式)。
(4)用电石渣处理酸性含铬(Cr2O72—)电镀废水的流程如下: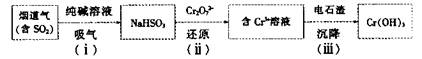
①步骤(i)发生反应的化学方程式为__________________
②步骤(ii)发生反应的离子方程式为__________________
③步骤(iii)调节溶液pH为8,则残留Cr3+的浓度为______(Ksp[Cr(OH)3]=6.3×10—31)。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学与生产、生活息息相关, 下列叙述错误的是
| A.铁表而镀锌可以增强其抗腐蚀性 |
| B.用聚乙烯塑料代替聚乳酸塑料可减少白色污染 |
| C.大量燃烧化石燃料是造成雾霾天气的一种重要因素 |
| D.含再金属离子的电镀废液不能随意排放 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com