
【题目】钠和钠的化合物有许多重要的用途。
(1)碳酸钠可用于从海水提取溴,涉及的反应如下:3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3,在上述反应中用双线桥法标出电子转移的方向和数目_______________;该反应中氧化剂与还原剂的物质的量之比是 __________。
(2)少量的钠应保存在_________中;钠着火时应采取的灭火措施是_______。
(3)过氧化钠作潜艇供氧剂时发生的化学反应方程式是__________________;该反应的氧化产物是_____________。
(4)厨房中存放的纯碱和小苏打无法用外观区别时,请你设计用厨房现有的物质来区分它们的方法_________________。
【答案】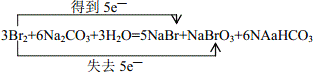 5 :1煤油用沙土扑灭2Na2O2+2CO2=2Na2CO3+O2O2取等量的白醋与两种物质反应,观察反应的剧烈程度,反应较剧烈的为小苏打;另一种则为纯碱
5 :1煤油用沙土扑灭2Na2O2+2CO2=2Na2CO3+O2O2取等量的白醋与两种物质反应,观察反应的剧烈程度,反应较剧烈的为小苏打;另一种则为纯碱
【解析】
(1)根据3Br2+6Na2CO3+3H2O=5NaBr+NaBrO3+6NaHCO3反应中,溴元素的化合价由0价分别变为-1价和+5价,其它各元素的化合价都不变,溴既是氧化剂又是还原剂,结合元素化合价变化解答该题。
(2)钠与水反应生成氢氧化钠和氢气;根据钠的密度比水小比煤油大及其性质特别活泼易与水等反应来判断。
(3)根据过氧化钠与二氧化碳反应生成碳酸钠和氧气,过氧化钠在反应中既做氧化剂又做还原剂进行分析。
(4)利用纯碱和小苏打与酸反应的快慢来分析。
(1)反应3Br2+6NaOH=5NaBr+NaBrO3+3H2O中,溴元素的化合价由0价分别变为-1价和+5价,溴既是氧化剂又是还原剂,氧化产物是溴酸钠,还原产物是溴化钠,由化学方程式可以知道氧化剂和还原剂物质的量之比为5:1,用双线桥标出电子转移的方向和数目为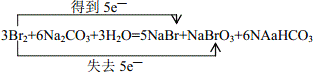 ,
,
因此,本题正确答案是: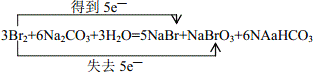 ,5:1。
,5:1。
(2)钠的性质非常活泼,钠与水反应生成氢氧化钠和氢气,钠与氧气反应生成氧化钠;又因为钠的密度比水小比煤油大,所以少量的钠应保存在煤油中;钠着火时应采取的灭火措施是:用干的沙土灭火;正确答案:煤油;干的沙土灭火。
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气,该反应为2Na2O2+CO2═2Na2CO3+O2;过氧化钠中氧元素为-1价,可以升高到0价,可以降低到-2价,因此氧化产物为氧气;正确答案是:2Na2O2+CO2═2Na2CO3+O2;O2。
(4)因为纯碱(碳酸钠)与酸反应没有小苏打(碳酸氢钠)与酸反应产生的气泡快,所以厨房里可以用等量的醋滴入两种固体,产生气泡快的为小苏打;正确答案:取等量的白醋与两种物质反应,观察反应的剧烈程度,反应较剧烈的为小苏打;另一种则为纯碱。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于四个“封管实验”![]() 夹持装置未画出、
夹持装置未画出、![]() 固体易升华
固体易升华![]() 的说法正确的是
的说法正确的是
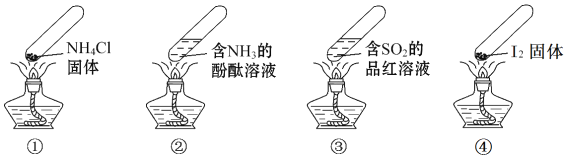
A. 加热时,![]() 中封管内固体消失
中封管内固体消失
B. 加热时,![]() 中溶液变红,冷却后又变为无色
中溶液变红,冷却后又变为无色
C. 加热时,![]() 中溶液变红,冷却后红色褪去,体现
中溶液变红,冷却后红色褪去,体现![]() 的漂白性
的漂白性
D. 加热又冷却的过程中,![]() 属于物理变化,
属于物理变化,![]() 属于化学变化
属于化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件已略去)。A是由两种元素组成的难溶于水的物质,两种元素的质量比为7:4;B是强酸;C的摩尔质量为34g·mol-1; F是最常见的无色液体;无色气体G能使品红溶液褪色;向含有I的溶液中滴加KSCN溶液,溶液出现血红色。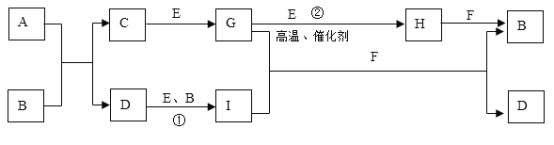
请回答下列问题:
(1)A的化学式____________________________。
(2)C的电子式____________________________。
(3)反应①的离子方程式_______________________________________________________。
(4)反应②的化学方程式_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语解释相关现象正确的是( )
A. BaSO4的水溶液导电性极弱:BaSO4![]() Ba2++SO42-
Ba2++SO42-
B. 常温下,0.1mol/L的HF溶液的pH>1:HF+H2O![]() H3O++F-
H3O++F-
C. KHSO4在熔融状态下可导电:KHSO4=K++H++SO42-
D. 向KI-淀粉溶液中滴加稀硫酸,溶液变蓝色:4I-+O2+2H2O=2I2+4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R2O8n-在一定条件下可以把 Mn2+氧化为 MnO4-,若反应后 R2O8n-变成 RO42-,又知反应中氧化剂与还原剂的物质的量之比为 5:2,则 R2O8n-中 R 元素的化合价为( )
A. +7 B. +6 C. +3 D. +5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:
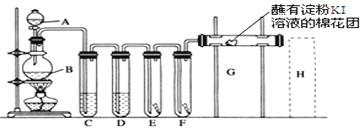
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式___________________。
(2)D中放入浓H2SO4其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论是________________________________。
(4)G处的现象是____________________________________。
(5)用化学方程式写出H处尾气吸收装置中的反应原理____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①消毒液与洁厕灵不能同时使用,原因是(用离子方程式表示)____________。
②需“密闭保存”的原因____________________________________________。
(7)工业上用亚氯酸钠和稀盐酸为原料制备 ClO2 ,写出反应的化学方程式____________。Cl2和ClO2都是强氧化剂,能杀死水中的病菌。等质量的ClO2的氧化能力是Cl2的_______倍。
(8)氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,如:[(SCN)2+H2O = HSCN+HSCNO]。它们阴离子的还原性强弱为 Cl-<Br-<CN-<SCN-<I-。试写出:KBr和KSCN的混合溶液中加入(CN)2,反应的化学方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成环反应在有机合成中具有重要应用,某环状化合物G的合成过程如下:

(1)A→B为加成反应,则B的结构简式是______;B→C的反应类型是______.
(2)G中含有的官能团名称是______;F的化学式为______.
(3)D→E的化学方程式是___________________________________________.
(4)H是F的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O—).H的结构简式是________________.
(5)由C通过加聚反应合成的高分子化合物M的化学方程式为______.
(6)下列说法正确的是______.
a.A能和HCl反应得到聚氯乙烯的单体
b.D和F中均含有2个π键
c.1mol G完全燃烧生成8mol H2O
d.F能发生加成反应、取代反应、氧化反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 碳酸钙与盐酸反应:CO32-+2H+=H2O+CO2↑
B. 将氯气溶于水制备次氯酸:Cl2+H2O =2H++Cl-+ClO-
C. 氢氧化钡溶液与稀H2SO4 反应:Ba2++SO42-=BaSO4↓
D. 氯化铜溶液与铁粉反应:Cu2++Fe=Fe2++Cu
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com