
【题目】同温同压下,下列各组热化学方程式中,△H1<△H2是
A.C(s)+![]() O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H2
B.![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
Cl2(g)=HCl(g);△H1 H2(g)+Cl2(g)=2HCl(g);△H2
C.S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g); △H2
D.2H2(g)+O2(g)=2H2O(g);△H1 2H2(g)+O2(g)=2H2O(l);△H2
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:ⅰ.反应A中,4 mol HCl被氧化,放出115.6 kJ的热量。
ⅱ.
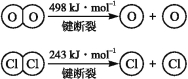
(1)反应A的热化学方程式是 。
(2)断开1 mol H—O键与断开1 mol H—Cl键所需能量相差约为 kJ,H2O中H—O键比HCl中H—Cl键(填“强”或“弱”) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
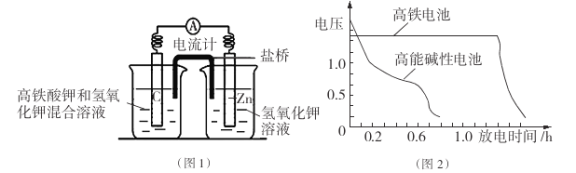
(1)该电池放电时正极的电极反应式为 ;若维持电流强度为1A,电池工作十分钟,理论消耗Zn g(已知F="96500" C/mol)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向 移动(填“左”或“右”)。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。
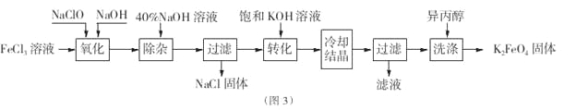
(4)完成“氧化”过程中反应的化学方程式:
![]()
其中氧化剂是 (填化学式)。
(5)加入饱和KOH溶液的目的是
(6)已知25℃时Ksp[Fe(OH)3]=4.0×![]() ,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入 mL 2 mol/L的盐酸(忽略加入盐酸体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 恒温恒压下,在容积可变的器皿中,反应2NO2 (g)![]() N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4 (g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A.减小 B.增大 C.不变 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:在298K、101kPa时,
①C(s,石墨)+O2(g) = CO2(g) △H1 = -400 kJ·mol-1;
②2H2(g)+O2(g) = 2H2O(l) △H2 = -570 kJ·mol-1;
③2C2H2(g)+5O2(g) = 4CO2(g)+ 2H2O(l) △H3 = -2600 kJ·mol-1;
写出298K时由C(s,石墨)和H2(g)生成1 mol C2H2(g)反应的热化学方程式 。以硫酸为电解质溶液,依据反应③设计一个燃料电池,写出其电极反应式 。
(2)工业合成氨的反应原理为 N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1某温度下,把10 mol N2与25mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为50%,则10 min内该反应的平均速率v(H2)= mol·L-1·min-1,则该温度下该反应的平衡常数K= 。
2NH3(g) ΔH=-92.4 kJ·mol-1某温度下,把10 mol N2与25mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为50%,则10 min内该反应的平均速率v(H2)= mol·L-1·min-1,则该温度下该反应的平衡常数K= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是 ( )
A. 催化剂能够改变化学反应路径 B. 升高温度提高了活化分子百分数
C. 增大反应物浓度提高了活化分子百分数 D. 增大压强能增大活化分子的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )

A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com