
【题目】W、X、Y、Z 是原子序数依次增大的四种短周期元素。W 的气态氢化物能使紫色石蕊溶液变蓝,W、X和Y三种元素的最高价氧化物的水化物两两之间可以发生反应,W、X、Y、Z 的最外层电子数之和为 16。回答下列问题:
(1)Z 单质的电子式是 ________________。W 的气态氢化物能使紫色石蕊溶液变蓝的原因:__________________(用化学方程式表示)。
(2)X、Y、Z 三种元素的简单离子的离子半径由大到小的顺序是:_____。
(3)Z 最高价氧化物对应的水化物化学式为 ____。
(4)Z 和氧元素、硫元素组成的 SOZ2 是一种液态化合物,沸点为 77℃,遇水能剧烈水解,有白雾和带有刺激性气味的气体逸出, 该气体可使滴有品红试液的滤纸褪色。请写出 SOZ2 和水反应的化学方程式_____。
【答案】![]() NH3+H2O
NH3+H2O![]() NH3·H2O Cl->Na+>Al3+ HClO4 SOCl2+H2O=SO2↑+2HCl↑
NH3·H2O Cl->Na+>Al3+ HClO4 SOCl2+H2O=SO2↑+2HCl↑
【解析】
因为W、X、Y、Z 是原子序数依次增大的短周期元素,W的气态氢化物能使紫色石蕊溶液变蓝,可确定W是氮元素。W、X和Y三种元素的最高价氧化物的水化物两两之间可以发生反应,可推测其中一种最高价氧化物的水化物具有两性,两性氢氧化物既可以与强酸反应,也可以与强碱反应,由此可确定X、Y。最后根据W、X、Y、Z 的最外层电子数之和为 16,计算Z的最外层电子数,可确定Z的元素种类。
因为W、X、Y、Z 是原子序数依次增大的短周期元素,W的气态氢化物能使紫色石蕊溶液变蓝,可确定W是氮元素。W、X和Y 三种元素的最高价氧化物的水化物两两之间可以发生反应,且W的最高价氧化物的水化物是HNO3(属于强酸),可推知其中一种元素是铝(其最高价氧化物的水化物是Al(OH)3,属于两性氢氧化物),另一种元素应该是活泼金属(其最高价氧化物的水化物是强碱),因此可确定X是钠、Y是铝。由于W、X、Y、Z 的最外层电子数之和为 16,所以Z的最外层电子数=16-5-1-3=7,又因Z的原子序数比Y大,所以Z为氯元素。结论:W为氮、X为钠、Y为铝、Z为氯。
(1)Z的单质是Cl2,两个氯原子间通过一对共用电子相结合,其电子式为![]() 。W 的气态氢化物是氨气,氨气能与水反应生成一水合氨,一水合氨属于弱碱使溶液显碱性,发生反应的化学方程式为:NH3+H2O
。W 的气态氢化物是氨气,氨气能与水反应生成一水合氨,一水合氨属于弱碱使溶液显碱性,发生反应的化学方程式为:NH3+H2O![]() NH3·H2O。
NH3·H2O。
(2) X、Y、Z分别对应的离子符号是Na+、Al3+、Cl-,Na+与Al3+的电子层结构相同(都是10个电子),因为核电荷数越大离子半径越小,所以Na+半径大于Al3+半径。而Cl-核外有18个电子,其电子层比Na+和Al3+多一层,因此Cl-半径比Na+和Al3+半径都大,所以三种简单离子的离子半径由大到小的顺序是Cl->Na+>Al3+。
(3)Z为氯元素,其最高价为+7价,氯元素的最高价氧化物对应的水化物化学式为HClO4。
(4)因SOCl2遇水能剧烈水解,“有白雾产生”推测有HCl气体生成;“有能使滴有品红试液的滤纸褪色”推测有SO2产生,HCl和SO2都具有刺激性气味。所以SOCl2水解反应的化学方程式为SOCl2+H2O=SO2↑+2HCl↑。


科目:高中化学 来源: 题型:
【题目】下列有关化学用语使用正确的是
A. 核内质子数为117、中子数为174的核素Ts可表示为:![]()
B. 甲烷分子的比例模型: ![]()
C. COCl2的结构式为:![]()
D. H2O2的电子式为:H+[ ![]() ]2-H+
]2-H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铟主要用于生产液晶显示器和平板屏幕。从LCD废料(主要成分是含铟、锡的氧化物)中回收铟的工艺流程如下:
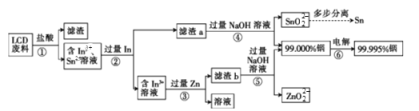
(1)步骤①中用盐酸酸浸时浸出率随温度变化关系如图所示,则最适宜的温度是___________,温度升高浸出率下降的原因是__________
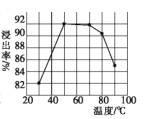
(2)酸浸时铟的氧化物转化成In3+的离子方程式是__________
(3)提纯粗铟的方法和铜的精炼原理相似,则粗铟为__________(填“阴极”或“阳极”),写出阴极的电极反应式: ______________________________
(4)步骤④中所发生氧化还原反应的氧化剂是__________(填化学式),步骤⑤中所发生氧化还原反应的氧化产物与还原产物系数之比是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是核电荷数依次增大的五种短周期主族元素。A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E元素同主族。
(1)B在元素周期表中的位置是_________。
(2)E元素形成的最高价氧化物对应的水化物的化学式为______,由A、B、C三种元素形成的离子化合物的化学式为______。
(3)C、D、E形成的简单离子的半径大小关系是_________(用离子符号表示)。
(4)用电子式表示化合物A2C的形成程:____________________________,化合物D2C2中含有的化学键是____________________________________。
(5)化合物D2C2与A2C反应的化学方程式 ____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,发生反应3A(g)+B(g)![]() 2Z(g),若最初A的物质的量浓度是2mol/L,测得10s内A的平均反应速率υ(A)=0.15mol/(Ls),则反应进行到10s时容器中A的物质的量浓度是
2Z(g),若最初A的物质的量浓度是2mol/L,测得10s内A的平均反应速率υ(A)=0.15mol/(Ls),则反应进行到10s时容器中A的物质的量浓度是
A. 3mol/L B. 1.2 mol/L C. 0.5mol/L D. 3.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,在2 L容器中A、B两种物质间的转化反应中,A、B物质的量随时间变化的曲线如下图所示,由图中数据分析得:
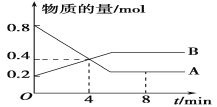
①该反应的化学方程式为____________________;
②反应开始至4 min时,B的平均反应速率为________ ,A的反应速率为_____ ,A的转化率为_____。
③4 min时,反应是否达到平衡状态?________(填“是”或“否”),8 min时,v(正)________v(逆)(填“>”、“<”或“=”)。
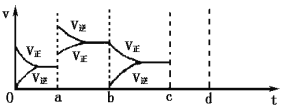
(2)下图表示在密闭容器中反应:2SO2(g) + O2(g)![]() 2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是______________;b时改变的条件可能是______________。
2SO3(g)△H<0达到平衡时,由于条件改变而引起反应速率和化学平衡的变化情况,a时改变的条件可能是______________;b时改变的条件可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟化锂(LiF)难溶于水,可用于核工业、光学玻璃制造等。以透锂长石(含Li2O、Al2O3、SiO2)为原料制备氟化锂的工艺流程如下:
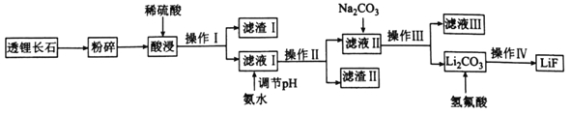
回答下列问题:
(1)滤液I中含有的金属离子有________,滤渣I的一种用途是________________。
(2)滤渣Ⅱ是目前应用最广泛的无机阻燃剂,写出生成滤渣Ⅱ的离子方程式:________________。常温下,若向滤液I中滴加氨水调节pH=5时,溶液中c(Al3+)=________mol·L-1,则溶液中A13+________(填“是”或“否”)沉淀完全(已知Ksp[Al(OH)3]=2.0×10-33,且溶液中的离子浓度小于1.0×10-5mol·L-1时沉淀完全)。
(3)操作Ⅳ包括________________、________________和干燥。
(4)写出Li2CO3与氢氟酸反应的化学方程式:________________________,该反应不能在玻璃容器中进行的原因是________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应中,反应混合物A、B、C的物质的量浓度(c)与时间(t)关系如下所表示

下列说法错误的是( )
A. 该反应的化学方程式为2A![]() 4B+C B. 逆反应是放热反应
4B+C B. 逆反应是放热反应
C. 4min时A的转化率约为31% D. 4~6min时,反应处于动态平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com