
(10分)绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是
(2)操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至pH=2的目的是 。
(3)操作IV的顺序依次为: 、冷却结晶、 。
(4)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为: 。
②计算上述样品中FeSO4·7H2O的质量分数为 (用小数表示,保留三位小数)。
(本题10分,前6个每空1分,后2个空每空2分)
(1)取少量晶体溶于水,滴加KSCN溶液,若溶液不显现红色表明溶液不含Fe3+
(2)①除去溶液中的Sn2+离子,并防止Fe2+被氧化 ② 防止Fe2+离子生成沉淀
(3)蒸发浓缩 过滤洗涤
(4)降低洗涤过程中FeSO4·7H2O的损耗
(5)①5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O ②0.975
【解析】(1)检验铁离子的常用试剂是KSCN溶液,操作是取少量晶体溶于水,滴加KSCN溶液,若溶液不显现红色表明溶液不含Fe3+。
(2)①由于滤液中含有Sn2+离子,所以通入H2S的目的是除去溶液中的Sn2+离子,保证能制得纯净的绿矾;又因为亚铁离子极易被氧化,而H2S具有还原性,所以H2S的另外作用是防止Fe2+被氧化。
②由于SnS沉淀完全时溶液的pH为1.6,而FeS开始沉淀时溶液的pH为3.0,所以在溶液中用硫酸酸化至pH=2的目的是防止Fe2+离子生成沉淀。
(3)从溶液中得到绿矾晶体的操作是蒸发浓缩、冷却结晶、过滤洗涤。
(4)由于绿矾的溶解度随温度的升高而增大,所以用冰水洗涤的目的是降低洗涤过程中FeSO4·7H2O的损耗。
(5)①首先高锰酸钾溶液具有强氧化性,能把亚铁离子氧化生成铁离子,反应的离子方程式是5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O。
②根据方程式可知,25ml溶液中含有的亚铁离子的物质的量是 0.01000mol/L×0.020L×5=0.001mol,因此样品中FeSO4·7H2O的质量分数为
 。
。


科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
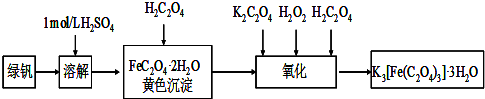
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
| O | 2- 7 |
| O | 2- 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com