
【题目】将一定量的Cl 2 通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO- 和ClO3-两种离子的物质的量( n )与反应时间( t )的变化示意图如图所示。 下列说法正确的是( )
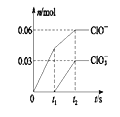
A. 苛性钾溶液中KOH的物质的量为0.18mol
B. 反应中转移电子的物质的量是0.09 mol
C. 在酸性条件下ClO- 和ClO3-能反应得到氯气
D. ClO3-的生成可能是由于温度升高引起的
【答案】D
【解析】A.根据电子转移守恒可知n(Cl-)=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,根据物料守恒可知n(K+)=n(Cl-)+n(ClO-)+n(ClO3-)=0.21mol+0.06mol+0.03mol=0.3mol,则n(KOH)=0.3mol,故A错误;B.氯气和氢氧化钾溶液反应生成次氯酸钾、氯化钾和氯酸钾,根据图像知n(ClO-)=0.06mol,n(ClO3-)=0.03mol,故转移电子物质的量=0.06mol×(1-0)+0.03mol×(5-0)=0.21mol,故B错误;C.ClO-中Cl元素的化合价是+1价,ClO3-中Cl元素的化合价是+5价,因此两者反应不可能生成Cl2,故C错误;D.根据图像知,氯气和氢氧化钾先生成次氯酸钾,且该反应是放热反应,随着温度的升高,氯气和氢氧化钾反应生成氯酸钾,所以氯酸根离子的生成是由于温度升高引起的,故D正确;故选D。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3,还含有Fe2O3、SiO2等杂质。
Ⅰ.从铝土矿中提取氧化铝的流程如下图所示:
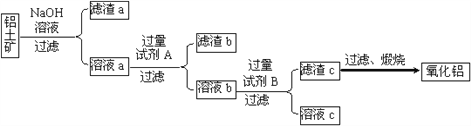
(1)试剂A是________;溶液b与试剂B反应的离子方程式为________。
(2)加入NaOH溶液进行的反应的离子方程式为_________、____________。
Ⅲ.新型陶瓷氮化铝可用以下两种方法制备
(3)①氧化铝高温还原法: Al2O3 + C + N2 ![]() AlN + CO(请配平)
AlN + CO(请配平)
②氯化铝与氨气高温合成法:AlCl3+NH3 ![]() AlN+3HCl
AlN+3HCl
(4)方法②比方法①在生产上更具优势。下列说法中,正确的是_______。
A.方法①中的 Al2O3、C、N2结构稳定,反应时破坏化学键需要消耗更多的能量
B.方法①中的Al2O3和C容易残留在氮化铝中
C.两种方法中氮化铝均为还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应2KI+O3+H2O ==2KOH+I2+O2,下列说法正确的是
A.当有2 molKI被氧化时,2 mol氧原子被还原
B.O2是还原产物
C.若消耗2.24 L O3,则转移0.2 mol电子
D.氧化剂与还原产物的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D,E五种元素中,A原子3p轨道上成对电子数等于未成对电子数,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,C的价电子排布式为nsnnpn+2 , D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A的最高价氧化物的化学式为 , 中心原子的VSEPR构型为 .
(2)AC2与BC2分子的立体结构分别是和 , 相同条件下两者在水中的溶解度较大的是(写分子式),理由是 .
(3)D的元素符号是 , 它的核外电子排布式的简化式为 .
(4)用氢键表示写出E的氢化物的水溶液中存在的所有氢键 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配平下列化学方程式(其中(3)用双线桥标出转移的电子数
(1) Cu + HNO3(稀) — Cu(NO3)2 + NO↑ + H2O___________
(2) S+ NaOH— Na2S+ Na2SO3+ H2O_______________
(3) KClO3+ HCl— KCl+ Cl2↑+ H2O_____________
(4) Cr2O72-+ Fe2++ — Cr3++ Fe3++ ,_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表为元素周期表中的一部分,列出了10种元素在元素周期表中的位置.用化学符号回答下列各问题.
主族 | ||||||||
周期 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)10种元素中,第一电离能最大的是;电负性最小的金属是 .
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是 .
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是: .
(4)①和⑨的最高价氧化物对应水化物的化学式为和 . ①和⑨两元素形成化合物的化学式为;该化合物灼烧时的焰色为色;该化合物的溶液与元素⑧的单质反应的化学方程式为 .
(5)①和⑤最高价氧化物对应水化物相互反应的化学方程式为;离子方程式为 .
(6)用电子式表示第三周期元素中由电负性最小的元素和电负性最大的元素形成化合物的过程 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L0.1mol·L-1 BaCl2溶液中,下列说法正确的是
A. Cl―物质的量为0.1mol B. Cl―物质的量浓度为0.2 mol·L-1
C. Ba2+物质的量为0.1mol D. Ba2+物质的量浓度为0.2 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com