
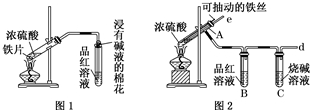
 某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.
某校化学兴趣小组为探究铁与浓硫酸反应,设计了图1、图2所示装置进行实验.分析 (1)②图2装置中Fe丝可以抽动,能控制反应的发生和停止,有尾气处理装置;
(2)二氧化硫能够使品红溶液褪色;
(3)验证Ⅲ:步骤1.检验Fe3+,加KSCN溶液,变红色;或加淀粉KI溶液,变蓝色;
步骤2.既有Fe3+又有Fe2+时,检验Fe2+要加酸性KMnO4溶液.
解答 解:(1)比较两个装置的不同点,发现发生装置设计不同,可抽动的铁丝可以随时控制反应的发生与停止,而铁片却不具有这样的优势;
故答案为:便于控制反应的发生和停止;
(2)二氧化硫能够使品红溶液褪色,如果生成二氧化硫则会看到品红溶液褪色;
故答案为:品红溶液褪色;
(3)Ⅲ为既有Fe3+又有Fe2+;验证Ⅲ的方法为:步骤1:检验Fe3+,加KSCN溶液或淀粉KI溶液,变红色或蓝色,发生的反应为:Fe3++3SCN-$\frac{\underline{\;\;△\;\;}}{\;}$Fe(SCN)3或 2Fe3++2I-=2Fe2++I2;
步骤2.再验证亚铁离子,需要使用酸性高锰酸钾溶液,方法为:加酸性KMnO4溶液,高锰酸钾溶液变浅红色证明有二价铁离子,
故答案为:C或D;红色或蓝色;Fe3++3SCN-$\frac{\underline{\;\;△\;\;}}{\;}$Fe(SCN)3或 2Fe3++2I-=2Fe2++I2;取少量溶液于试管中,滴加酸性高锰酸钾,若溶液颜色褪去,证明含Fe2+.
点评 本题通过浓硫酸的性质,侧重考查性质实验方案的设计与评价,题目难度中等,明确铁离子、亚铁离子的检验方法为解答关键,注意掌握性质实验方案的设计原则,试题充分考查了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
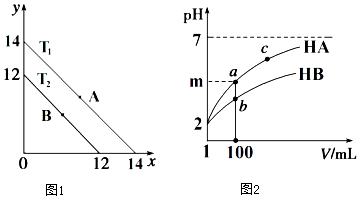 (1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.
(1)溶液中,c(H+)=10-x mol•L-1,c(OH-)=10-y mol•L-1,x与y的关系如图1所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热为221KJ/mol | |
| B. | 稀盐酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热值为57.3KJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1mol水,放出的热量57.3KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO固体(Al2O3) | B. | Na2CO3固体(NaHCO3) | ||
| C. | FeCl2溶液(CuCl2) | D. | Fe2O3固体(SiO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室制取乙酸乙酯的主要步骤如下
实验室制取乙酸乙酯的主要步骤如下| 物质 | 乙醇 | 乙酸 | 乙酸乙酯 | 浓硫酸 |
| 熔(℃) | -117.0 | 16.6 | -83.6 | ------ |
| 沸(℃) | 78.0 | 117.9 | 77.5 | 338.0 |
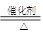 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
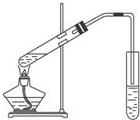 (A)如图为实验室用CH3COOH与CH3CH218OH制备乙酸乙酯的装置.
(A)如图为实验室用CH3COOH与CH3CH218OH制备乙酸乙酯的装置.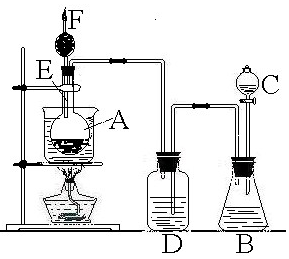
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
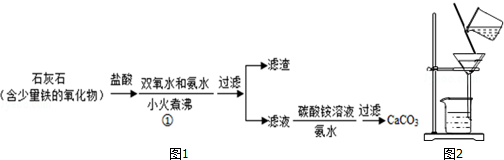
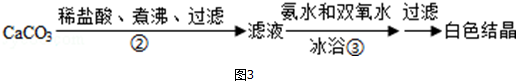
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com