
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
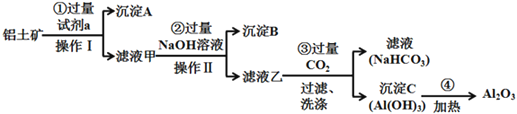
(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH-=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________;
【答案】SiO2 Fe3++3OH-=Fe(OH)3↓ Al3++4OH-=AlO2-+2H2O CO2+OH- = HCO3-;AlO2-+ CO2+2H2O = HCO3- +Al(OH)3 ↓
【解析】
根据工艺流程得出试剂a为盐酸,氧化铝、氧化铁与盐酸反应生成氯化铝和氯化铁,而二氧化硅和盐酸不反应,沉淀A为二氧化硅,滤液中有氯化铝、氯化铁、过量盐酸,再加氢氧化钠溶液,得到氢氧化铁沉淀和偏铝酸钠溶液,过滤,沉淀B为氢氧化铁,滤液为偏铝酸钠与二氧化碳反应生成氢氧化铝和碳酸氢钠溶液,氢氧化铝加热变为氧化铝。
(1)二氧化硅不与盐酸反应,因此沉淀A的成分是(填化学式) SiO2,故答案为:SiO2。
(2)步骤②滤液主要是氯化铝、氯化铁、过量盐酸,加入过量NaOH溶液,先发生酸碱中和反应,再与铁离子和铝离子反应,发生反应的离子方程式,除了H++OH- = H2O还有:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O;故答案为:Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O。
(3)步骤③中通入过量CO2气体,先氢氧化钠和二氧化碳反应,再是偏铝酸钠和二氧化碳反应生成碳酸氢钠和氢氧化铝,其离子方程式有CO2+OH- = HCO3-;AlO2-+ CO2+2H2O = HCO3- +Al(OH)3 ↓,故答案为:CO2+OH- = HCO3-;AlO2-+ CO2+2H2O = HCO3- +Al(OH)3 ↓。


科目:高中化学 来源: 题型:
【题目】下图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生。一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g。下列有关说法中正确的是
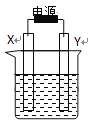
A. X电极连接电源正极
B. 生成气体体积为0.56L
C. Y电极上发生氧化反应
D. 该CuCl2溶液浓度为0.05mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学方程式的说法正确的是
A. H2的燃烧热为285.8 kJ·mol1,则表示H2燃烧的热化学方程式可表示为:H2(g)+ ![]() O2
O2![]() H2O(g) ΔH=285.8 kJ·mol1
H2O(g) ΔH=285.8 kJ·mol1
B. 中和热为57.3 kJ·mol1,则NaOH与醋酸反应的中和热可以表示如下:NaOH(aq)+CH3COOH(aq)![]() CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
CH3COONa(aq)+H2O(l) ΔH=57.3 kJ·mol1
C. 已知:C(s,金刚石)+O2(g)![]() CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)
CO2(g) ΔH=395.4 kJ·mol1,C(s,石墨)+O2(g)![]() CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)
CO2(g) ΔH=393.5 kJ·mol1,则C(s,金刚石)![]() C(s,石墨)ΔH=1.9 kJ·mol1
C(s,石墨)ΔH=1.9 kJ·mol1
D. 已知1 mol CH4完全燃烧生成CO2和液态水放出890.4 kJ的热量,则该反应中转移1 mol电子时放出的热量为222.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2 mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。图中横坐标表示加入NaOH溶液的体积,纵坐标表示生成沉淀的质量,有关说法正确的是( )
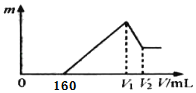
A.V1=400
B.金属粉末中含铝1.35 g
C.最后剩余沉淀质量5.8 g
D.无法确定V2的数值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)SO2在烟尘的催化下形成硫酸的反应方程式是_____。
(2)NOx和SO2在空气中存在下列平衡:
2NO(g)+O2(g)![]() 2NO2(g) △H=-113.0kJmol-1
2NO2(g) △H=-113.0kJmol-1
2SO2(g)+O2(g)![]() 2SO3(g) △H=-196.6kJmol-1
2SO3(g) △H=-196.6kJmol-1
SO2通常在二氧化氮的存在下,进一步被氧化,生成SO3。
①写出NO2和SO2反应的热化学方程式为_____。
②随温度升高,该反应化学平衡常数变化趋势是____。
(3)提高2SO2+O2![]() 2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
2SO3反应中SO2的转化率,是减少SO2排放的有效措施。
①T温度时,在1L的密闭容器中加入2.0molSO2和1.0molO2,5min后反应达到平衡,二氧化硫的转化率为50%,该反应的平衡常数是___。
②在①中条件下,反应达到平衡后,改变下列条件,能使SO2的转化率提高的是____(填字母)。
a.温度和容器体积不变,充入1.0molHe
b.温度和容器体积不变,充入1.0molO2
c.在其他条件不变时,减少容器的体积
d.在其他条件不变时,改用高效催化剂
e.在其他条件不变时,升高体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g)H2(g)+I2(g) △H<0
(1)该反应平衡常数的表达式为K=___。
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为____,HI的分解率为____。
(3)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则该时刻,反应向____(填“正向”或“逆向”,下同)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
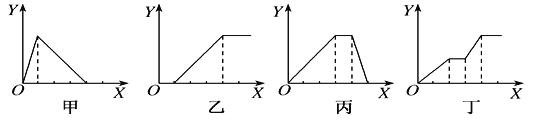
A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环氧乙烷常用于一次性口罩生产过程中灭菌和新冠病毒的消杀,工业上常利用乙烯直接氧化法生产环氧乙烷(![]() ),发生的反应如下。
),发生的反应如下。
主反应Ⅰ:2CH2=CH2(g)+O2(g)![]() 2
2![]() (g)
(g) ![]() =-210kJ·mol-1
=-210kJ·mol-1
副反应Ⅱ:CH2=CH2(g)+3O2(g)![]() 2CO2(g)+2H2O)(l)
2CO2(g)+2H2O)(l)![]() =-1324kJ·mol-1
=-1324kJ·mol-1
Ⅲ.2![]() (g)+5O2(g)
(g)+5O2(g)![]() 4CO2(g)+4H2O(g)
4CO2(g)+4H2O(g)![]()
已知:环氧乙烷选择性是指乙烯进行反应Ⅰ生成环氧乙烷的优势。
(1)![]() =_________kJ·mol-1。
=_________kJ·mol-1。
(2)①图1是乙烯转化率、环氧乙烷选择性与流速关系的图象,图中随进料气的流速加快,乙烯的转化率下降,其可能原因是_________________。

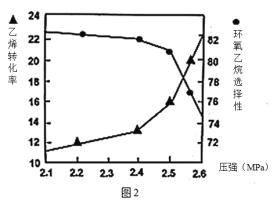
②图2是乙烯转化率、环氧乙烷选择性与压强关系的图象,图中当反应体系的压强高于2.4MPa,环氧乙烷选择性下降,其可能原因是__________________。
(3)实验测得反应Ⅰ中,v正=K正·x2(CH2=CH2)·x(O2),v逆=K逆·x2(![]() ),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
),(式中x为物质的量分数;K正、K逆为速率常数,只与温度有关)。
①若在1L的密闭容器中充2molCH2=CH2(g)和1molO2(g),在一定温度下只发生反应,达到平衡时CH2=CH2的转化率为75%,则该反应平衡常数的值为___________。
②若平衡后仅升高温度,则下列说法正确的是___________。
a.x(CH2=CH2)增大,x(![]() )减小
)减小
b.K正与K逆的比值增大
c.v正减小,v逆增大
d.K正与K逆的比值减小
(4)将乙烯与饱和食盐水的电解产物反应,转化为氯乙醇[CH2(OH)CH2C],氯乙醇进一步反应生成环氧乙烷,其电解简易装置如右图所示。
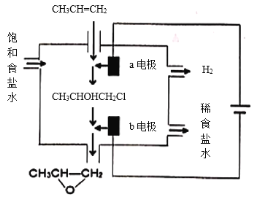
已知:CH2=CH2+H2O+Cl2→CH2(OH)CH2Cl+HCl
①a电极为___________(选填“阴极”或“阳极”)。
②b电极区域生成环氧乙烷的化学方程式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com