
【题目】将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g)H2(g)+I2(g) △H<0
(1)该反应平衡常数的表达式为K=___。
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为____,HI的分解率为____。
(3)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则该时刻,反应向____(填“正向”或“逆向”,下同)进行。
【答案】![]() 0.5mol/L 20% 正向
0.5mol/L 20% 正向
【解析】
(1)根据平衡常数的含义书写;
(2)根据反应方程式中物质的变化关系确定H2的平衡浓度、HI的分解浓度,进而可得HI的起始浓度;
(2)将该时刻各种物质的浓度带入浓度商公式计算数值,并与K比较大小,判断平衡移动方向。
(1)由于化学平衡常数是可逆反应达到化学平衡状态时,各种生成物浓度幂之积与各种反应物浓度幂之积的比,所以反应2HI(g)H2(g)+I2(g)的平衡常数表达式为:K=![]() ;
;
(2)当反应达到平衡时c(I2)=0.5mol/L,根据方程式可知:每有2个HI分解,就会产生1个I2和1个H2,所以反应消耗的HI的浓度是1mol/L,反应产生的H2的平衡浓度c(H2)=0.5mol/L,由于平衡时c(HI)=4mol/L,所以反应前HI的总浓度为c(HI)(起始)=4mol/L+1mol/L=5mol/L,因此 HI 的分解率为:![]() ×100%=20%;
×100%=20%;
(3)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的浓度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则此时浓度商Qc=![]() =0.25<K=1,表明反应物浓度较大,反应向着正向移动。
=0.25<K=1,表明反应物浓度较大,反应向着正向移动。


科目:高中化学 来源: 题型:
【题目】某小组在探究Fe2+性质的实验中观察到异常现象。
实验Ⅰ | 现象 |
| 溶液变红,片刻红色褪去,有气体生成(经检验为O2)。 |
资料:ⅰ.Fe3++3SCN-=Fe(SCN)3(红色),Fe(SCN)3中S元素的化合价为2价
ⅱ.BaSO4是不溶于盐酸的白色沉淀
(1)实验Ⅰ体现了Fe2+的__性,补全H2O2与FeCl2酸性溶液反应的离子方程式:__Fe2+ +__H2O2+__H+ =__Fe3++__H2O
(2)探究“红色褪去”的原因,进行实验Ⅱ:将褪色后的溶液分三份分别进行实验。

实验Ⅱ得出的结论是:红色褪去的原因是__。
(3)为进一步探究“红色褪去”的原因,进行了实验Ⅲ。
实验Ⅲ | 现象 |
| 溶液变红,一段时间后不褪色。 |
取上述反应后的溶液,滴加盐酸和BaCl2溶液 | 无白色沉淀产生。 |
分析上述三个实验,下列叙述正确的是__(填字母)。
A.实验Ⅲ中发生了氧化还原反应:4Fe2++O2+4H+=4Fe3++2H2O
B.通过实验Ⅲ推出实验Ⅰ中氧化FeCl2的只有O2
C.O2在该实验条件下不能使红色溶液褪色
D.实验Ⅰ中红色褪去与H2O2的氧化性有关
(4)上述实验探究过程用到的实验方法有__(写出一条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将二氧化钛(TiO2)光电极嵌入到新型钠离子电池的正极,由于光电势的补偿,电池的充电电位下降。该光电极辅助充电时的工作原理如图所示,下列说法错误的是

A.充电时阳极的电极反应式为3I--2e-=I3-
B.放电时,a极发生氧化反应
C.放电时,正、负极反应的微粒数目比为4:3
D.辅助充电时,光能转化为电能,再转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A. 该反应的焓变ΔH>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中![]() =3
=3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
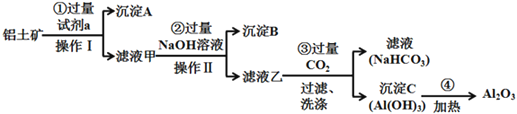
(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH-=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明BF3分子中四个原子在同一平面的理由是
A. 任意两个键的夹角为120°B. B―F键是非极性共价键
C. 三个B―F键的键能相同D. 三个B―F键的键长相等
查看答案和解析>>
科目:高中化学 来源: 题型:
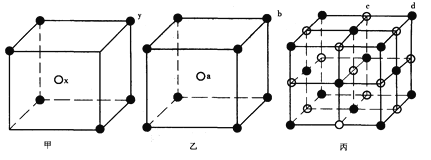
【题目】现有甲、乙、丙(如下图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2X+Y![]() 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是

A. T1时,v正>v逆
B. 正反应的△H<0
C. a、b两点的反应速率va=vb
D. T<T1时,ω增大的原因是平衡向正方向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com