
【题目】能说明BF3分子中四个原子在同一平面的理由是
A. 任意两个键的夹角为120°B. B―F键是非极性共价键
C. 三个B―F键的键能相同D. 三个B―F键的键长相等
【答案】A
【解析】
根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数,BF3中B原子sp2杂化,分子构型为平面三角形,4个原子处于同一平面,所以3个B-F的键角均为120°能说明BF3分子中的4个原子处于同一平面,据此分析解答。
BF3分子中价层电子对个数=3+![]() ×(3-3×1)=3形成了三个杂化轨道,即B的杂化类型为sp2,形成3个共用电子对,无孤对电子,所以该分子是平面三角形结构。
×(3-3×1)=3形成了三个杂化轨道,即B的杂化类型为sp2,形成3个共用电子对,无孤对电子,所以该分子是平面三角形结构。
A.BF3中B原子sp2杂化,分子构型为平面三角形,则其分子结构必然是三个F原子分别处在以硼为中心的平面三角形的三个顶点上,所以当3个B-F的键角均为120°,能说明BF3分子中的4个原子处于同一平面,A正确;
B.B、F是两种不同的元素,所以B—F键是极性共价键,但这与分子是否为平面分子无关,不能说明BF3分子中的4个原子处于同一平面,B错误;
C.3个B-F键相同,键能相同,但这不能说明BF3分子中的4个原子处于同一平面,C错误;
D.3个B-F键相同,键长相同,不能说明BF3分子中的4个原子处于同一平面,D错误;
故合理选项是A。


科目:高中化学 来源: 题型:
【题目】对于相同温度、相同压强下,相同物质的量的SO2和SO3,下列说法中正确的是( )
A.硫元素的质量比为5:4B.质量之比为1:1
C.分子数之比为5:4D.密度之比为4:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr(OH)3是类似Al(OH)3的两性氢氧化物,Ksp[Al(OH)3]=1.3×10-33,Ksp[Cr(OH)3]=6.3×10-31。如图为Cr和Al两种元素在水溶液中存在的形式与pH的关系,图中纵轴表示lgc(M3+)或lgc[M(OH)4-](其中M=Al或Cr)。下列说法错误的是( )
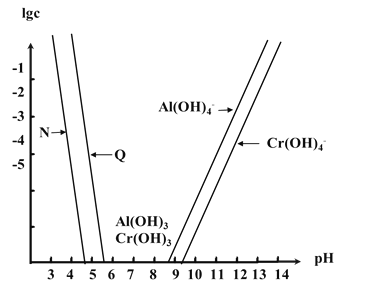
A.曲线N表示Al3+的浓度变化
B.在Al(OH)3和Cr(OH)3混合悬浊液中滴加NaOH溶液,Al(OH)3先溶解
C.在Al(OH)3和Cr(OH)3共沉淀的体系中![]() ≈4.8×102
≈4.8×102
D.若溶液中Al3+和Cr3+起始浓度均为0.1molL-1,通过调节pH能实现两种元素的分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为充分利用资源,变废为宝,实验室里利用废铁屑制取硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]。某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O42H2O),进一步制备高纯度还原铁粉。
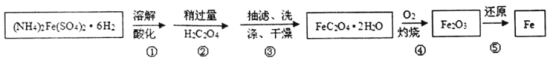
已知:FeC2O42H2O难溶于水,150℃开始失结晶水:H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)步骤②中,H2C2O4稍过量主要原因是_________________。
(2)为了提高步骤③得到的FeC2O42H2O的纯度,宜用_________________(填热水、冷水或无水乙醇)洗涤,检验洗涤是否干净的操作是_________________。
(3)实现步骤④必须用到的两种仪器是_________________(供选仪器:a.烧杯;b. 坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶):
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3, 理由是_________________。
(5)硫酸亚铁铵是重要的工业原料,其溶解性如表所示:
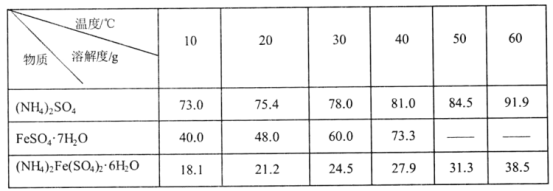
(注意:高于73.3℃,FeSO47H2O发生分解)
以铁屑(有油污)、硫酸、硫酸较为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,_________________冷却,过滤,用蒸馏水洗涤铁屑至中性,将铁屑置于锥形瓶中,_________________至铁屑完全溶解,_________________,冷却结晶,用无水乙醇洗涤2-3次,低温干操。[实验中必须使用的试剂:铁屑、1.0molL-1的Na2CO3溶液、3.0molL-1的H2SO4溶液,饱和(NH4)2SO4溶液]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g)H2(g)+I2(g) △H<0
(1)该反应平衡常数的表达式为K=___。
(2)当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为____,HI的分解率为____。
(3)若该反应800℃时达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2.0mol/L,c(I2)=1.0mol/L,c(H2)=1.0mol/L,则该时刻,反应向____(填“正向”或“逆向”,下同)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.56 g Fe在足量Cl2中充分燃烧,转移电子数为2×6.02×1023
B.合成氨反应放热,采用低温可以提高氨的生成速率
C.常温下Na2CO3溶液中加入少量Ca(OH)2固体,溶液中![]() 的值减小
的值减小
D.若电工操作中将铝线与铜线直接相连会导致铜线更快被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)除去NaCO3粉末中混入的NaHCO3杂质用__________方法,化学方程式为____。
(2)除去氧化铜粉末中混入的氧化铝粉末通常用________试剂,离子方程式为________。
(3)通常用________试剂除去CO2中的HCl气体,离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是

A. II表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C. V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-)
D. V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.实验室常用排饱和食盐水的方法收集氯气
B.合成氨反应中,为提高氢气的转化率,理论上应采取加压的措施
C.对于2HI(g) ![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
D.反应CO(g)+NO2(g) ![]() CO2(g)+NO(g) △H<0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g) △H<0,达平衡后,升高温度体系颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com