
【题目】已知Cr(OH)3是类似Al(OH)3的两性氢氧化物,Ksp[Al(OH)3]=1.3×10-33,Ksp[Cr(OH)3]=6.3×10-31。如图为Cr和Al两种元素在水溶液中存在的形式与pH的关系,图中纵轴表示lgc(M3+)或lgc[M(OH)4-](其中M=Al或Cr)。下列说法错误的是( )
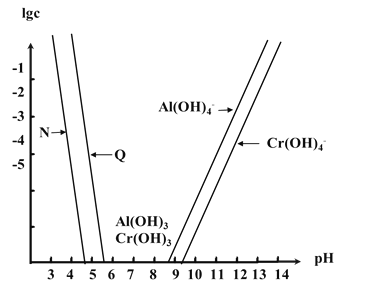
A.曲线N表示Al3+的浓度变化
B.在Al(OH)3和Cr(OH)3混合悬浊液中滴加NaOH溶液,Al(OH)3先溶解
C.在Al(OH)3和Cr(OH)3共沉淀的体系中![]() ≈4.8×102
≈4.8×102
D.若溶液中Al3+和Cr3+起始浓度均为0.1molL-1,通过调节pH能实现两种元素的分离
科目:高中化学 来源: 题型:
【题目】在温度和容积不变的密闭容器中,A气体与B气体反应生成C气体。反应过程中,反应物与生成物的浓度随时间变化的曲线如图所示,则下列叙述正确的是( )
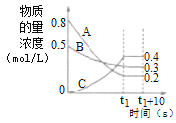
A.该反应的化学方程式为A(g)+3B(g)2C(g)
B.(t1+10)s时,升高温度,正、逆反应速率加快
C.在t1s时,V正(A)=0
D.若该反应在绝热容器中进行,也在t1时刻达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫及其化合物的说法中正确的是( )
A.浓硫酸与灼热的炭反应,体现了浓硫酸的强氧化性和酸性
B.浓硫酸具有吸水性,可做干燥剂,不能干燥 NH3、 H2S等气体
C.SO2 和 Cl2 均可使品红溶液褪色,但将溶有 SO2 的品红溶液加热后又恢复红色,说明 SO2 的氧化性没有 Cl2 强
D.以 FeS和稀硫酸反应制H2S气体为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“生活无处不化学”,请你回答下列问题。
(1)厨房中的调味品,①盐(主要成分氯化钠)、②碱面(主要成分碳酸钠)、③白醋(主要成分乙酸)。主要成分中具有碱性的是_____(填序号,下同);属于盐类的是______;相互间能发生反应的是________。
(2)食盐不慎洒落在天然气的火焰上,观察的现象是_______________,该变化称为______反应。
(3)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是__________________。
(4)家庭中常用“84”消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。
“消毒液”与“洁厕灵”同时使用会产生有毒的氯气,写出该反应的离子方程式:____________________________________________。
(5)纯碱(Na2CO3)、小苏打(NaHCO3)广泛应用在食品加工。苏打饼干原料中含有小苏打,在烘焙受热过程中,小苏打发生分解反应,该反应的化学方程式是_____________________________________;苏打饼干可以适当缓解人体胃酸(主要成分盐酸)过多症状,该反应的离子方程式是__________________________________________。
(6)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将二氧化钛(TiO2)光电极嵌入到新型钠离子电池的正极,由于光电势的补偿,电池的充电电位下降。该光电极辅助充电时的工作原理如图所示,下列说法错误的是

A.充电时阳极的电极反应式为3I--2e-=I3-
B.放电时,a极发生氧化反应
C.放电时,正、负极反应的微粒数目比为4:3
D.辅助充电时,光能转化为电能,再转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.5 mol/L碳酸钠溶液和100 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则关于盐酸的浓度可能是( )
A.0.25 mol/LB.0.5 mol/LC.0.75 mol/LD.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A. 该反应的焓变ΔH>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中![]() =3
=3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明BF3分子中四个原子在同一平面的理由是
A. 任意两个键的夹角为120°B. B―F键是非极性共价键
C. 三个B―F键的键能相同D. 三个B―F键的键长相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10mL0.1mol·L-1醋酸溶液测得其pH=3。0.1mol·L-1氨水(NH3·H2O溶液)的pH=___。用pH试纸测定该氨水pH的操作方法为_____。氨水(NH3·H2O溶液)电离平衡常数表达式Kb=____,25℃时,氨水电离平衡常数约为_____。
(2)25℃时,现向10mL0.1mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中![]() ___(填序号)。
___(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL0.1mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。
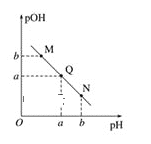
图中M、Q、N三点所示溶液呈中性的点是____(填字母,下同)。图中M、Q、N三点所示溶液中水的电离程度最大的点是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com