
【题目】已知:25℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10mL0.1mol·L-1醋酸溶液测得其pH=3。0.1mol·L-1氨水(NH3·H2O溶液)的pH=___。用pH试纸测定该氨水pH的操作方法为_____。氨水(NH3·H2O溶液)电离平衡常数表达式Kb=____,25℃时,氨水电离平衡常数约为_____。
(2)25℃时,现向10mL0.1mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中![]() ___(填序号)。
___(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL0.1mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。
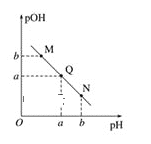
图中M、Q、N三点所示溶液呈中性的点是____(填字母,下同)。图中M、Q、N三点所示溶液中水的电离程度最大的点是____。
【答案】11 取一小段pH试纸放在表面皿上,用洁净的玻璃棒蘸取氨水溶液滴在pH试纸上,然后与标准比色卡对照读取pH值 ![]() 10-5 b Q Q
10-5 b Q Q
【解析】
(1)醋酸的电离平衡常数等于NH3·H2O的电离平衡常数,因此氨水中c(OH-)=10-3mol·L-1,根据水的离子积,c(H+)=Kw/c(OH-)=10-14/10-3=10-11mol·L-1,因此pH=11,取一小段pH试纸放在表面皿上,用洁净的玻璃棒蘸取氨水溶液滴在pH试纸上,然后与标准比色卡对照读取pH值;③根据电离平衡常数的定义,因此Kb=![]() ,弱电解质的电离微弱,NH3·H2O的浓度仍为0.1mol·L-1,Kb=10-310-3/0.1=10-5。故答案为:11;取一小段pH试纸放在表面皿上,用洁净的玻璃棒蘸取氨水溶液滴在pH试纸上,然后与标准比色卡对照读取pH值;
,弱电解质的电离微弱,NH3·H2O的浓度仍为0.1mol·L-1,Kb=10-310-3/0.1=10-5。故答案为:11;取一小段pH试纸放在表面皿上,用洁净的玻璃棒蘸取氨水溶液滴在pH试纸上,然后与标准比色卡对照读取pH值;![]() ;10-5;
;10-5;
(2)NH3·H2O![]() NH4++OH-,加入醋酸,消耗OH-,促进电离,n(NH4+)增加,n(NH3·H2O)降低,比值增大,故选项b正确。
NH4++OH-,加入醋酸,消耗OH-,促进电离,n(NH4+)增加,n(NH3·H2O)降低,比值增大,故选项b正确。
(3)溶液显中性,即c(OH-)=c(H+),即Q点,酸和碱抑制水的电离,随着反应进行,碱性减弱,对水电离抑制减弱,恰好反应,生成醋酸钠,发生盐类水解,促进水的电离,然后随着醋酸的增多,对水的抑制增加,因此水电离程度最大的是Q点。故答案为Q,Q。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知Cr(OH)3是类似Al(OH)3的两性氢氧化物,Ksp[Al(OH)3]=1.3×10-33,Ksp[Cr(OH)3]=6.3×10-31。如图为Cr和Al两种元素在水溶液中存在的形式与pH的关系,图中纵轴表示lgc(M3+)或lgc[M(OH)4-](其中M=Al或Cr)。下列说法错误的是( )
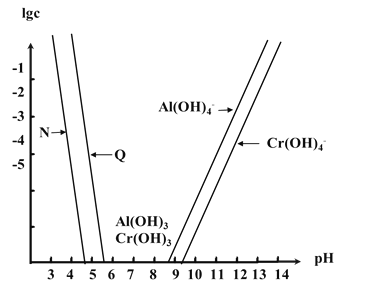
A.曲线N表示Al3+的浓度变化
B.在Al(OH)3和Cr(OH)3混合悬浊液中滴加NaOH溶液,Al(OH)3先溶解
C.在Al(OH)3和Cr(OH)3共沉淀的体系中![]() ≈4.8×102
≈4.8×102
D.若溶液中Al3+和Cr3+起始浓度均为0.1molL-1,通过调节pH能实现两种元素的分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)除去NaCO3粉末中混入的NaHCO3杂质用__________方法,化学方程式为____。
(2)除去氧化铜粉末中混入的氧化铝粉末通常用________试剂,离子方程式为________。
(3)通常用________试剂除去CO2中的HCl气体,离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.l00mol/L NaOH溶液分别滴定20.00 mL 0.100 mol/L的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是

A. II表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)小于20 mL
C. V(NaOH)=" 20.00" mL时,两份溶液中c(Cl-)= C(CH3COO-)
D. V(NaOH) ="10.00" mL时,醋酸溶液中c(Na+)> C(CH3COO-)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的悬浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示,试回答:
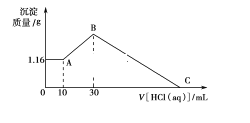
(1)A点→B点反应的离子方程式为____________________________________。
(2)原混合物中AlCl3的物质的量为________________,NaOH的物质的量为___________________。
(3)HCl溶液在C点的加入量是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;f可作电极材料下列有关说法正确的是
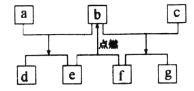
A.简单氢化物的沸点:Y>X
B.简单离子的半径:Y>Z>X
C.阳离子的氧化性:Y>Z
D.b和g所含的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧性硫酸盐还原菌(SRB)是导致金属微生物腐蚀最为普遍的菌种,铸铁管的一种腐蚀图解如图所示。下列说法正确的是
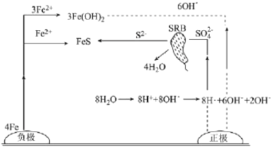
A.生成1molFeS,负极质量增加32g
B.正极区溶液的pH变小
C.正极电极反应式为:8H++8e-=8H·(吸附)、SO42-+8H·(吸附)+8e-![]() S2-+4H2O
S2-+4H2O
D.总反应:4Fe+4H2O+SO42-![]() FeS+3Fe(OH)2+2OH-
FeS+3Fe(OH)2+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.实验室常用排饱和食盐水的方法收集氯气
B.合成氨反应中,为提高氢气的转化率,理论上应采取加压的措施
C.对于2HI(g) ![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
D.反应CO(g)+NO2(g) ![]() CO2(g)+NO(g) △H<0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g) △H<0,达平衡后,升高温度体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。
(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。
①使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:_____________________。
②醛类、O3、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图1所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议:________________________________。
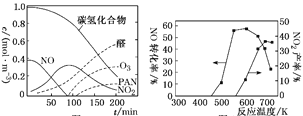
图1 图2
(2)利用NH3催化还原氮氧化物(SCR技术)是目前应用广泛的烟气脱硝技术。SCR技术的主要反应之一为4NO(g)+4NH3(g)+O2(g) ![]() 4N2(g)+6H2O(g)ΔH=-1627.2 kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700 ℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是__________________________。(用化学方程式表达)
4N2(g)+6H2O(g)ΔH=-1627.2 kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700 ℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是__________________________。(用化学方程式表达)
(3)目前,科学家还在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。
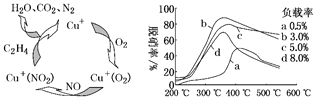
图3 图4
①写出该脱硝原理总反应的化学方程式_____。(已知NO与C2H4体积比为3:1)
②为达到最佳脱硝效果,应选择的条件是_________________________________。
(4)NO(g)与CO(g)催化转化成N2(g)和CO2(g)的反应达到平衡后,20min时,若改变反应条件,导致N2浓度发生如下图5所示的变化,则改变的条件可能是________(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2的量 D.缩小容器体积
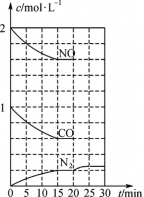
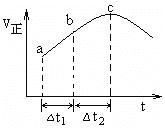
图5 图6
(5)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g) +NO(g),正反应速率随时间变化如图6所示。由图可得出的正确结论是___(填字母)
SO3(g) +NO(g),正反应速率随时间变化如图6所示。由图可得出的正确结论是___(填字母)
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com