
【题目】下列事实不能用勒夏特列原理解释的是
A.实验室常用排饱和食盐水的方法收集氯气
B.合成氨反应中,为提高氢气的转化率,理论上应采取加压的措施
C.对于2HI(g) ![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
D.反应CO(g)+NO2(g) ![]() CO2(g)+NO(g) △H<0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g) △H<0,达平衡后,升高温度体系颜色变深
科目:高中化学 来源: 题型:
【题目】能说明BF3分子中四个原子在同一平面的理由是
A. 任意两个键的夹角为120°B. B―F键是非极性共价键
C. 三个B―F键的键能相同D. 三个B―F键的键长相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10mL0.1mol·L-1醋酸溶液测得其pH=3。0.1mol·L-1氨水(NH3·H2O溶液)的pH=___。用pH试纸测定该氨水pH的操作方法为_____。氨水(NH3·H2O溶液)电离平衡常数表达式Kb=____,25℃时,氨水电离平衡常数约为_____。
(2)25℃时,现向10mL0.1mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中![]() ___(填序号)。
___(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL0.1mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。
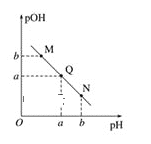
图中M、Q、N三点所示溶液呈中性的点是____(填字母,下同)。图中M、Q、N三点所示溶液中水的电离程度最大的点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL浓硫酸和铜片加热后反应,铜片完全溶解后测得产生4.48L(标况下)气体,把反应后的溶液稀释至1L,取20mL溶液加入足量BaCl2溶液产生3.262g沉淀,求原硫酸溶液的物质的量浓度是多少______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO与N2O在铁催化剂表面进行如下两步反应,其相对能量与反应历程如图所示。
第一步:Fe*+N2O=FeO*+N2
第二步:FeO*+CO=Fe*+CO2
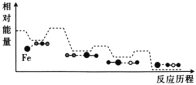
下列叙述错误的是( )
A.Fe*是反应的催化剂
B.两步反应的ΔH均小于0
C.第一步反应比第二步反应快
D.总反应为CO+N2O=N2+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A→C必须加热,否则会发生钝化现象。请回答下列问题:
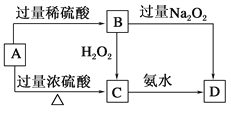
(1)A是________,你推断的理由是___________________。
(2)B在酸性条件下与H2O2反应的离子方程式:_____________________。
(3)A与过量浓H2SO4反应的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热),测得反应的相关数据如下:
2SO3(g)(正反应放热),测得反应的相关数据如下:
容器1 | 容器2 | 容器3 | |
反应温度T/K | 700 | 700 | 800 |
反应物投入量 | 2 mol SO2、 1 mol O2 | 4 mol SO3 | 2 mol SO2、 1 mol O2 |
平衡υ正(SO2)/mol·L-1·s-1 | v1 | v2 | v3 |
平衡c(SO3)/mol·L-1 | c1 | c2 | c3 |
平衡体系总压强p/Pa | p1 | p2 | p3 |
物质的平衡转化率α | α1(SO2) | α2(SO3) | α3(SO2) |
平衡常数K | K1 | K2 | K3 |
下列说法正确的是
A.υ1<υ3,α1(SO2)>α3(SO2)
B.K1>K3,p2>2p3
C.c2>2c3,α2(SO3)+α3(SO2)>1
D.υ1<υ2,c2<2c1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com