
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。
【答案】A、C 烧杯、玻璃棒、500mL容量瓶 BCD 2.0 小于 13.6 15
【解析】
(1)配制一定物质的量浓度溶液的一般步骤:计算、称量或者量取、溶解或者稀释、移液、洗涤、定容、摇匀,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,所以用不到的仪器:平底烧瓶、分液漏斗;还缺少的仪器:烧杯、玻璃棒、500mL容量瓶;
(2)A.容量瓶是带有活塞的仪器,使用前要检查是否漏水,故A正确;
B.容量瓶用蒸馏水洗净后,不能够使用待配溶液润洗,否则导致配制的溶液浓度偏高,故B错误;
C.容量瓶是精密定量仪器,只能用于配制一定物质的量浓度的溶液,不能用于溶解,应该在烧杯中溶解固体,故C错误;
D.容量瓶是精密定量仪器,只能用于配制一定物质的量浓度的溶液,不能用于稀释浓溶液,应该在烧杯中稀释浓溶液,故D错误;
E.摇匀的正确操作为:盖好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转和摇动多次,故E正确;
答案为BCD;
(3)需要0.1mol/LNaOH溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量=0.1mol/L×0.5L×40g/mol=2.0g;若定容时仰视刻度线,导致溶液体积偏小,所配溶液浓度偏低;
(4)浓H2SO4的物质的量浓度c=![]() mol/L=18.4mol/L,稀释前后溶质的物质的量不变,设需要浓硫酸的体积为V,则:V×18.4mol/L=0.5L×0.5mol/L,解得V=13.6ml,应选用15mL规格的量筒。
mol/L=18.4mol/L,稀释前后溶质的物质的量不变,设需要浓硫酸的体积为V,则:V×18.4mol/L=0.5L×0.5mol/L,解得V=13.6ml,应选用15mL规格的量筒。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.10 mol·L-1CuCl2溶液中滴加0.10 mol/L mol·L-1硫化钠溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法正确的是

A. Ksp(CuS)的数量级是10-35
B. 曲线上a点溶液中,c(S2-) c(Cu2+)>Ksp(CuS)
C. a、b、c 三点溶液中,c(H+)和c(OH-)的积最小的为b点
D. c 点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型钮扣电池在现代生活中有着广泛的应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O,总反应为:Ag2O+Zn=2Ag+ZnO。根据上述反应式,下列叙述中正确的是
A. 在使用过程中,电池负极区溶液pH增大
B. 外电路中每通过0.2mol电子,正极的质量理论上减小3.2g
C. 在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D. 在使用过程中,电流由Ag2O极经外电路流向Zn极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2 (g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生下列反应:I2(g)+H2(g)![]() 2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
2HI(g)(正反应为放热反应)。起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变填入相关的表格中(填“增大”“减小”或“不变”)。
编号 | 改变的条件 | 反应速率 |
(1) | 升高温度 | ______ |
(2) | 加入正催化剂 | ______ |
(3) | 再充入a mol H2 | ______ |
(4) | 将容器的容积扩大到原来的2倍 | ______ |
(5) | 保持容积不变,通入b mol Ne | ______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)在0~1 min、1~2 min、2~3 min、3~4 min、4~5 min时间段中,反应速率最大的时间段是________,原因为______________________;反应速率最小的时间段是________,原因为__________________________。
(2)在2~3 min内,用盐酸的浓度变化表示的反应速率为________。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液,其中可行的是________。
A.蒸馏水 B.Na2SO4溶液
C.NaNO3溶液 D.Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 的硫酸溶液进行中和热的测定。
 Ⅰ.配制0.50mol·L- 1 硫酸溶液
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为98%的浓硫酸 mL。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1) ;
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c=" 4.18" J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。

③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差 |
B.量取NaOH溶液的体积时仰视读数 |
C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中 |
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是最简单的烃,是一种重要的化工原料。
(1)以甲烷为原料,有两种方法合成甲醇:
方法I:①![]()
![]()
②![]()
![]()
方法Ⅱ:③![]()
![]() _______kJ/mol
_______kJ/mol
(2)在密闭容器中充入2 mol CH4 (g)和1 molO2 (g),在不同条件下进行反应:![]() 。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。

①P1时升高温度,n(CH3OH)____(填“增大”、“减小”或“不变”);P1__P2(填“>"、“<”或“=”);
②E、F、N点对应的化学反应速率由大到小的顺序为____(用v(E)、v(F)、v(N)表示);
③下列能提高CH4平衡转化率的措施是____(填序号);
a.选择高效催化剂 b.增大![]() 投料比 c.及时分离产物
投料比 c.及时分离产物
④若F点,n (CH3 OH) =1mol,总压强为2.5MPa,则To时F点用分压强代替浓度表示的平衡常数Kp=____。
(3)使用新型催化剂进行反应2CH4 (g)+O2(g)![]() 2CH3OH(g)。随温度升高CH3OH的产率如图所示。
2CH3OH(g)。随温度升高CH3OH的产率如图所示。

①CH3OH产率在T1至T2时很快增大的原因是 ____;
②T2后CH3OH产率降低的原因可能是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:

已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分铜”时各元素的浸出率如下表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_______。
(2)“分金”时,单质金发生反应的离子方程式为________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。

“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为_______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度(假定溶液中Ag+浓度为0.1mol/L)。________。
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
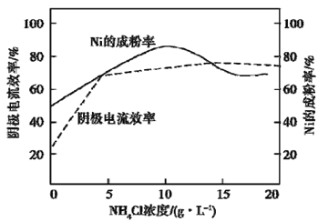
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com