
【题目】甲烷是最简单的烃,是一种重要的化工原料。
(1)以甲烷为原料,有两种方法合成甲醇:
方法I:①![]()
![]()
②![]()
![]()
方法Ⅱ:③![]()
![]() _______kJ/mol
_______kJ/mol
(2)在密闭容器中充入2 mol CH4 (g)和1 molO2 (g),在不同条件下进行反应:![]() 。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。

①P1时升高温度,n(CH3OH)____(填“增大”、“减小”或“不变”);P1__P2(填“>"、“<”或“=”);
②E、F、N点对应的化学反应速率由大到小的顺序为____(用v(E)、v(F)、v(N)表示);
③下列能提高CH4平衡转化率的措施是____(填序号);
a.选择高效催化剂 b.增大![]() 投料比 c.及时分离产物
投料比 c.及时分离产物
④若F点,n (CH3 OH) =1mol,总压强为2.5MPa,则To时F点用分压强代替浓度表示的平衡常数Kp=____。
(3)使用新型催化剂进行反应2CH4 (g)+O2(g)![]() 2CH3OH(g)。随温度升高CH3OH的产率如图所示。
2CH3OH(g)。随温度升高CH3OH的产率如图所示。

①CH3OH产率在T1至T2时很快增大的原因是 ____;
②T2后CH3OH产率降低的原因可能是____。
【答案】-251.0 减小 > ![]() (N)>
(N)>![]() (F)>
(F)>![]() (E) c 2MPa-1 温度升高反应速率加快,且在此温度下催化剂活性增强 该反应是放热反应,升高温度,平衡逆向移动,CH3OH产率降低
(E) c 2MPa-1 温度升高反应速率加快,且在此温度下催化剂活性增强 该反应是放热反应,升高温度,平衡逆向移动,CH3OH产率降低
【解析】
(1)根据盖斯定律,目标反应为[①+②]![]() 2,以此计算的反应热;
2,以此计算的反应热;
(2)①此反应的正反应是气体分子数减小的反应,增大压强,平衡向正反应方向移动;
②E、F点对应的温度相同;F、N点对应的压强相同;
③a.选择高效催化剂,只能加快反应速率,不能使平衡发生移动;
b.增大![]() 投料比,能提高O2转化率,CH4平衡转化率降低;
投料比,能提高O2转化率,CH4平衡转化率降低;
c.及时分离产物,平衡向正反应方向移动,转化率增大;
④列出三段式,找出各组分的平衡分压,代入平衡常数计算公式计算;
(3)①温度升高反应速率加快,且在此温度下催化剂活性增强,使产率增大;
②该反应是放热反应,升高温度,平衡逆向移动,CH3OH产率降低。
(1)①CH4(g)+![]() O2(g)
O2(g)![]() CO(g)+2H2(g)△H=-35.4kJmol-1
CO(g)+2H2(g)△H=-35.4kJmol-1
②CO(g)+2H2(g)![]() CH3OH(g)△H=-90.1kJmol-1
CH3OH(g)△H=-90.1kJmol-1
根据盖斯定律,[①+②]![]() 2得:2CH4(g)+O2(g)=2CH3OH(g) △H=[(-35.4kJ/mol)+(-90.1kJ/mol)]
2得:2CH4(g)+O2(g)=2CH3OH(g) △H=[(-35.4kJ/mol)+(-90.1kJ/mol)]![]() 2=-251.0 kJ/mol;
2=-251.0 kJ/mol;
因此,本题正确答案是:-251.0 ;
(2)①由反应式2CH4 (g)+O2(g)![]() 2CH3OH(g)可知,此反应的正反应是气体分子数减小的反应,增大压强,平衡向正反应方向移动。由图像可知,在相同压强下,随着温度升高,CH3OH(g)的物质的量减小,在相同温度下,P2到P1,CH3OH(g)的物质的量增大,说明平衡向正反应方向移动,即P1> P2。
2CH3OH(g)可知,此反应的正反应是气体分子数减小的反应,增大压强,平衡向正反应方向移动。由图像可知,在相同压强下,随着温度升高,CH3OH(g)的物质的量减小,在相同温度下,P2到P1,CH3OH(g)的物质的量增大,说明平衡向正反应方向移动,即P1> P2。
因此,本题正确答案是:减小;>;
②E、F点对应的温度相同,但F点对应的压强较大,反应速率较大;F、N点对应的压强相同,但N点对应的温度较高,反应速率较大。故化学反应速率由大到小的顺序为![]() (N)>
(N)>![]() (F)>
(F)>![]() (E),
(E),
因此,本题正确答案是:![]() (N)>
(N)>![]() (F)>
(F)>![]() (E);
(E);
③a.选择高效催化剂,只能加快反应速率,不能使平衡发生移动,不能提高CH4平衡转化率;
b.增大![]() 投料比,能提高O2转化率,CH4平衡转化率降低;
投料比,能提高O2转化率,CH4平衡转化率降低;
c.及时分离产物,平衡向正反应方向移动,转化率增大;
因此,本题正确答案是:c;
④若F点,n (CH3 OH) =1mol,总压强为2.5MPa,
2CH4 (g)+O2(g)![]() 2CH3OH(g)
2CH3OH(g)
起始量(mol) 2 1 0
转化量(mol) 1 0.5 1
平衡量(mol) 1 0.5 1
CH4 、O2和CH3OH的平衡分压分别为![]() 2.5MPa、
2.5MPa、![]() 2.5MPa、
2.5MPa、![]() 2.5MPa,即1 MPa、0.5MPa、1MPa,
2.5MPa,即1 MPa、0.5MPa、1MPa,
则平衡常数Kp=![]() =2MPa-1,
=2MPa-1,
因此,本题正确答案是:2MPa-1;
(3)①温度升高反应速率加快,且在此温度下催化剂活性增强,使产率增大;
②该反应是放热反应,升高温度,平衡逆向移动,CH3OH产率降低。
因此,本题正确答案是:温度升高反应速率加快,且在此温度下催化剂活性增强;该反应是放热反应,升高温度,平衡逆向移动,CH3OH产率降低。


科目:高中化学 来源: 题型:
【题目】滴滴涕(DDT)是20世纪60年代以前广为应用的一种杀虫剂,其结构简式为

DDT因其稳定性、脂溶性、药效普适性等特点而大量使用,最终造成环境污染。下列关于DDT的说法,不正确的是( )
A.DDT也能杀死有益的生物
B.DDT极易溶于水
C.DDT是烃的衍生物
D.DDT不易被生物分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是__________。

(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水 |
B.容量瓶用水洗净后,再用待配溶液洗涤 |
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。 |
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(3)根据计算用托盘天平称取的质量为______g。在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度_____0.1mol/L(填“大于”“小于”或“等于”)。
(4)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为_______mL,如果实验室有15mL、20mL、50mL量筒,应选用______mL量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验所得结论正确的是

A. ①中溶液红色褪去的原因是:CH3COOC2H5 + NaOH =CH3COONa + C2H5OH
B. ②中溶液变红的原因是:CH3COO- + H2O ![]() CH3COOH + H+
CH3COOH + H+
C. 由实验①、②、③推测,①中红色褪去的原因是乙酸乙酯萃取了酚酞
D. ④中红色褪去证明右侧小试管中收集到的乙酸乙酯中混有乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮氧化物等物质,造成严重的环境污染。煤的干馏是提高煤的利用率、生产重要化工原料、降低污染物排放量的有效措施之一。某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如图所示,请回答有关问题:

(1)煤干馏的条件是_______。
(2)盛有冷水的烧杯的作用是__________________
(3)实验后检验有粗氨水生成的操作是___
(4)已知CO不能使溴水褪色,若将从具支试管支管口处逸出的气体通入溴水中,发现溴水褪色,则说明煤的干馏产生了_______________________
(5)点燃尾气,火焰的颜色为________________________
(6)从煤焦油中分离出苯、甲苯、二甲苯的实验方法是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式__________________________。
(2)E中为红色干布条,F中为红色湿布条,可观察到的现象是________________________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(3)试管C和D中试剂各为_____________________________。
(4)装置G处发生反应的离子方程式为_______________________________。
(5)用离子方程式表示试剂X的作用_________________________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________________。
②需“密闭保存”的原因____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
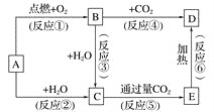
请填写下列空白:
(1)写出化学式:A____,B____,C_____,D____,E____。
(2)以上反应中,属于氧化还原反应的有____________(填写编号)。
(3)A→C反应的离子方程式是________。
(4) B→C反应的化学方程式是____________。
(5)E→D反应的化学方程式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一个容积可变的容器中,通入3 mol SO2和2 mol O2及固体催化剂,使之反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是( )
2SO3(g) ΔH=-196.6 kJ·mol-1,平衡时容器内气体压强为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol SO2、3 mol O2、2 mol SO3(g),下列说法正确的是( )
A. 第一次平衡时反应放出的热量为294.9 kJ
B. 两次平衡SO2的转化率相等
C. 第二次达平衡时SO3的体积分数大于![]()
D. 达平衡时用O2表示的反应速率为0.25 mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某杀菌药物M的合成路线如下图所示。

回答下列问题:
(1)A中官能团的名称是_______________。B→C的反应类型是__________________。
(2)B的分子式为________________________。
(3)C→D的化学方程式为__________________________。
(4)F的结构简式为___________________________。
(5)符合下列条件的C的同分异构体共有____________种(不考虑立体异构);
①能发生水解反应;②能与FeCl3溶液发生显色反应。
其中核磁共振氢谱为4组峰的结构简式为_______________(任写一种)。
(6)请以![]() 和CH3CH2OH为原料,设计制备有机化合物
和CH3CH2OH为原料,设计制备有机化合物 的合成路线(无机试剂任选)_______________。
的合成路线(无机试剂任选)_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com