
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。
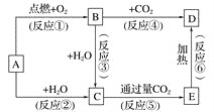
请填写下列空白:
(1)写出化学式:A____,B____,C_____,D____,E____。
(2)以上反应中,属于氧化还原反应的有____________(填写编号)。
(3)A→C反应的离子方程式是________。
(4) B→C反应的化学方程式是____________。
(5)E→D反应的化学方程式是_____________。
【答案】Na Na2O2 NaOH Na2CO3 NaHCO3 ①②③④ 2Na+2H2O=2Na++2OH-+H2↑ 2Na2O2+2H2O=4NaOH+O2↑ 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】
焰色反应为黄色的金属为钠,则A为钠,B为过氧化钠,C为氢氧化钠,D为碳酸钠,E为碳酸氢钠。发生反应的化学方程式为:2Na+O2![]() Na2O2,2Na+2H2O=2NaOH+H2↑,2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2,NaOH+CO2(过量)=NaHCO3,2NaHCO3
Na2O2,2Na+2H2O=2NaOH+H2↑,2Na2O2+2H2O=4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2,NaOH+CO2(过量)=NaHCO3,2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)A、B、C、D、E的化学式依次为 Na、Na2O2、NaOH、Na2CO3、NaHCO3。答案为:Na、Na2O2、NaOH、Na2CO3、NaHCO3。
(2)以上反应中,属于氧化还原反应的有①②③④。答案为①②③④
(3)A→C反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑。
答案为:2Na+2H2O=2Na++2OH-+H2↑
(4) B→C反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑。
答案为:2Na2O2+2H2O=4NaOH+O2↑
(5)E→D反应的化学方程式是2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。
答案为:2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】微型钮扣电池在现代生活中有着广泛的应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e-=ZnO+H2O,总反应为:Ag2O+Zn=2Ag+ZnO。根据上述反应式,下列叙述中正确的是
A. 在使用过程中,电池负极区溶液pH增大
B. 外电路中每通过0.2mol电子,正极的质量理论上减小3.2g
C. 在使用过程中,Zn电极发生还原反应,Ag2O电极发生氧化反应
D. 在使用过程中,电流由Ag2O极经外电路流向Zn极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 的硫酸溶液进行中和热的测定。
 Ⅰ.配制0.50mol·L- 1 硫酸溶液
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为98%的浓硫酸 mL。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1) ;
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c=" 4.18" J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。

③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差 |
B.量取NaOH溶液的体积时仰视读数 |
C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中 |
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷是最简单的烃,是一种重要的化工原料。
(1)以甲烷为原料,有两种方法合成甲醇:
方法I:①![]()
![]()
②![]()
![]()
方法Ⅱ:③![]()
![]() _______kJ/mol
_______kJ/mol
(2)在密闭容器中充入2 mol CH4 (g)和1 molO2 (g),在不同条件下进行反应:![]() 。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
。实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。

①P1时升高温度,n(CH3OH)____(填“增大”、“减小”或“不变”);P1__P2(填“>"、“<”或“=”);
②E、F、N点对应的化学反应速率由大到小的顺序为____(用v(E)、v(F)、v(N)表示);
③下列能提高CH4平衡转化率的措施是____(填序号);
a.选择高效催化剂 b.增大![]() 投料比 c.及时分离产物
投料比 c.及时分离产物
④若F点,n (CH3 OH) =1mol,总压强为2.5MPa,则To时F点用分压强代替浓度表示的平衡常数Kp=____。
(3)使用新型催化剂进行反应2CH4 (g)+O2(g)![]() 2CH3OH(g)。随温度升高CH3OH的产率如图所示。
2CH3OH(g)。随温度升高CH3OH的产率如图所示。

①CH3OH产率在T1至T2时很快增大的原因是 ____;
②T2后CH3OH产率降低的原因可能是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积。且有:
体积。且有:
C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2SO2+O2![]() 2SO3的叙述不正确的是( )
2SO3的叙述不正确的是( )
A.该反应是可逆反应
B.反应方程式中“![]() ”表示在相同条件下,反应可以同时向两个方向进行
”表示在相同条件下,反应可以同时向两个方向进行
C.1 mol O2与2 mol SO2混合反应,可生成2 mol SO3
D.在该反应中SO2作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于平衡体系mA(g)+nB(g) ![]() pC(g)+qD(g) ΔH<0。下列结论中错误的是
pC(g)+qD(g) ΔH<0。下列结论中错误的是
A. 若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则m+n<p+q
B. 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m∶n
C. 若m+n=p+q,则往含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a
D. 若温度不变时压强增大到原来的2倍,达到新平衡时,总体积一定比原来的![]() 要小
要小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】精炼铜工业中阳极泥的综合利用具有重要意义。一种从铜阳极泥(主要含有铜、银、金、少量的镍)中分离提取多种金属元素的工艺流程如下:

已知:ⅰ分金液中含金离子主要成分为[AuCl4]-;分金渣的主要成分为AgCl;
ⅱ分银液中含银离子主要成分为[Ag(SO3)2]3-,且存在[Ag(SO3)2]3—![]() Ag++2SO
Ag++2SO![]()
ⅲ“分铜”时各元素的浸出率如下表所示。

(1)由表中数据可知,Ni的金属性比Cu______。分铜渣中银元素的存在形式为(用化学用语表示)______。“分铜”时,如果反应温度过高,会有明显的放出气体现象,原因是_______。
(2)“分金”时,单质金发生反应的离子方程式为________。
(3)Na2SO3溶液中含硫微粒物质的量分数与pH的关系如图所示。

“沉银”时,需加入硫酸调节溶液的pH=4,分析能够析出AgCl的原因为_______。调节溶液的pH不能过低,理由为______(用离子方程式表示)。
(4)已知Ksp[Ag2SO4]=1.4×10-5,沉银时为了保证不析出Ag2SO4,应如何控制溶液中SO42—浓度(假定溶液中Ag+浓度为0.1mol/L)。________。
(5)工业上,用镍为阳极,电解0.1 mol/L NiCl2溶液与一定量NH4Cl组成的混合溶液,可得高纯度的球形超细镍粉。当其他条件一定时,NH4Cl的浓度对阴极电流效率及镍的成粉率的影响如图所示:
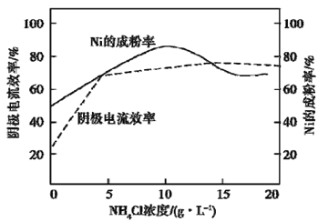
为获得髙纯度的球形超细镍粉,NH4Cl溶液的浓度最好控制为_______g/L,当NH4Cl溶液的浓度大于15g/L时,阴极有无色无味气体生成,导致阴极电流效率降低,该气体为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用如侧示意图象表示的是
反应 | 纵坐标 | 甲 | 乙 |
| |
A | 等质量的钾、钠分别与水反应 | H2的质量 | 钠 | 钾 | |
B | 相同质量的氨气在同一恒容容器发生2NH3 | NH3的转化率 | 500 | 400 | |
C | 体积比为1:3的N2、H2在体积可变的恒压容器中发生2NH3 | NH3的浓度 | 活性高的催化剂 | 活性一般的催化剂 | |
D | 2molSO2与1molO2在同温下发生2SO2+O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com