
����Ŀ������ƽ����ϵmA(g)��nB(g) ![]() pC(g)��qD(g)����H��0�����н����д������
pC(g)��qD(g)����H��0�������������
A. ���¶Ȳ��䣬�������������С��ԭ����һ�룬��ʱA��Ũ��Ϊԭ����2.1������m��n��p��q
B. ��ƽ��ʱ��A��B��ת������ȣ�˵����Ӧ��ʼʱ��A��B�����ʵ���֮��Ϊm��n
C. ��m��n��p��q����������a mol�����ƽ����ϵ���ټ���a mol��B���ﵽ��ƽ��ʱ������������ʵ�������2a
D. ���¶Ȳ���ʱѹǿ����ԭ����2�����ﵽ��ƽ��ʱ�������һ����ԭ����![]() ҪС
ҪС
���𰸡�D
��������
����Ũ�ȡ�ѹǿ���¶ȶԻ�ѧƽ���Ӱ��������
A����������С��ԭ��һ�루����ѹ����˲����A��Ũ��Ϊԭ����2������ƽ��ʱA��Ũ��Ϊԭ����2.1������ƽ�����ơ���ƽ���ƶ�ԭ������m��n ��p��q��A����ȷ��
B�����ʼʱA��B�����ʵ����ֱ�Ϊx��y��ƽ��ʱA��B��ת���ʷֱ�Ϊ����������(x��)��(y��)��m��n����������ʱ��x��y��m��n��B����ȷ��
C�m��n��p��qʱ����Ӧ����������������䡣������a mol�����ƽ����ϵ���ټ���a mol B�������Ƿ�ﵽ��ƽ�⣬���������ʵ���������2a mol��C����ȷ��
D�����С�������ʹ��ƽ��ѹǿ��ԭ����2��������ƽ�����С��ԭ����![]() ����ͨ���뷴Ӧ�ص�����ʹѹǿ���ԭ����2������������Բ��䡣D�����
����ͨ���뷴Ӧ�ص�����ʹѹǿ���ԭ����2������������Բ��䡣D�����
����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪298 Kʱ���ϳɰ���ӦN2(g)��3H2(g)![]() 2NH3(g)����H����92.0 kJ��mol��1�������¶��µ�1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ(�ٶ�����������û��������ʧ)
2NH3(g)����H����92.0 kJ��mol��1�������¶��µ�1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų�������Ϊ(�ٶ�����������û��������ʧ)
A. һ��С��92.0 kJ B. һ������92.0 kJ
C. һ������92.0 kJ D. ��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����úֱ����Ϊȼ��ȼ�գ�������Ч�ʽϵͣ��Ҳ����̳���������������������ʣ�������صĻ�����Ⱦ��ú�ĸ��������ú�������ʡ�������Ҫ����ԭ�ϡ�������Ⱦ���ŷ�������Ч��ʩ֮һ��ij��ѧѧϰС����ʵ����������̽��ú����������װ����ͼ��ʾ����ش��й����⣺

(1)ú�����������_______��
(2)ʢ����ˮ���ձ���������__________________
(3)ʵ�������дְ�ˮ���ɵIJ�����___
(4)��֪CO����ʹ��ˮ��ɫ�������Ӿ�֧�Թ�֧�ܿڴ��ݳ�������ͨ����ˮ�У�������ˮ��ɫ����˵��ú�ĸ��������_______________________
(5)��ȼβ�����������ɫΪ________________________
(6)��ú�����з���������ױ������ױ���ʵ�鷽����_________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ�У�AΪһ�ֳ����ĵ��ʣ�B��C��D��E�Ǻ�AԪ�صij�����������ǵ���ɫ��Ӧ��Ϊ��ɫ��
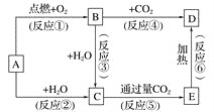
����д���пհף�
(1)д����ѧʽ��A____��B____��C_____��D____��E____��
(2)���Ϸ�Ӧ�У�����������ԭ��Ӧ����____________(��д���)��
(3)A��C��Ӧ�����ӷ���ʽ��________��
(4) B��C��Ӧ�Ļ�ѧ����ʽ��____________��
(5)E��D��Ӧ�Ļ�ѧ����ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС���о�AgCl���ܽ�ƽ�⣺��10 mL 1mol/L KCl ��Һ�м���1 mL 0.2 mol/LAgNO3��Һ��������Һ����Ϊ2�ݣ���������ʵ�飺
ʵ����� | ʵ����� | ʵ������ |
I | ������һ�ݻ���Һ���ˣ�����Һ�з���Mg��
| i. ��Һ���������ü��������ж�������� ii. ����Mg������������ɫ���ݲ����������ȼ����Һ�г��ְ�ɫ���ǡ� iii. һ��ʱ���ʼ�����غ�ɫ�����Mg������Ҳ��Ϊ�غ�ɫ���������ݵ����ʱ仺���� |
II | ����һ�ݻ���Һ�з����С��ͬ��Mg��
| iv. �غ�ɫ������������Զ���ʵ��I��Mg�������غ�ɫ�������������ii��iii��ͬ�� |
��֪��AgOH���ȶ��������ֽ�ΪAg2O���غ�ɫ���غ�ɫ����Ag��Ϊ��ɫ��AgCl��Ag2O������Ũ��ˮ����Ag(NH3)2��
��1����Һ������ɢϵΪ________��
��2������ii����ɫ���ݲ�����ԭ����_________��д����ѧ����ʽ����
��3������iii�У����²������ݵ������½�����ҪӰ��������________��
��4������ΪMg��������غ�ɫ������һ����Ag��Ag2O����������Ag�����ӷ���ʽΪ____��
��5�������ʵ�����Ag��ȡʵ��I�б����Ϊ�غ�ɫ��Mg�����Թ��У������м��������Լ�a����Ӧ�������������м���Ũ���ᣬ������ɫ���壬��Һ���а�ɫ�����
�� ��ɫ������Ϊ_____���ѧʽ������ɫ���������ԭ����_____��д���ӷ���ʽ����
�� �Լ�aΪ________�������Լ�a��Ŀ����________��
�� ��ʵ����֤���غ�ɫ������һ����Ag��ʵ��������________��
��6����һ�����ʵ����֤��Mg��������غ�ɫ��������Ag2O��ʵ�鷽���ǣ�ȡʵ��I�б����Ϊ�غ�ɫ��Mg��_________��
��7���ۺ�����ʵ�飬��˵������AgCl(s) ![]() Ag+(aq) + Cl��(aq)��֤�ݼ�������________��
Ag+(aq) + Cl��(aq)��֤�ݼ�������________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���һ���ݻ��ɱ�������У�ͨ��3 mol SO2��2 mol O2�����������ʹ֮��Ӧ��2SO2(g)��O2(g) ![]() 2SO3(g)����H����196.6 kJ��mol��1��ƽ��ʱ����������ѹǿΪ��ʼʱ��90%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼ���ʵ�����Ϊ4 mol SO2��3 mol O2��2 mol SO3(g)������˵����ȷ����(����)
2SO3(g)����H����196.6 kJ��mol��1��ƽ��ʱ����������ѹǿΪ��ʼʱ��90%������ͬһ��Ӧ�¶ȣ�����ͬ�����У�����ʼ���ʵ�����Ϊ4 mol SO2��3 mol O2��2 mol SO3(g)������˵����ȷ����(����)
A. ��һ��ƽ��ʱ��Ӧ�ų�������Ϊ294.9 kJ
B. ����ƽ��SO2��ת�������
C. �ڶ��δ�ƽ��ʱSO3�������������![]()
D. ��ƽ��ʱ��O2��ʾ�ķ�Ӧ����Ϊ0.25 mol��(L��min)��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A.FeO��ϡ���ᷴӦ���ڸ��ֽⷴӦ
B.������Fe��Ũ�����Ӧ
C.ͭƬ��Ũ���ᷢ�����ӷ�Ӧ��Cu+NO3-+4H+=Cu2++NO2��+2H2O
D.��Fe(NO3)2ϡ��Һ�м������ᷢ����Ӧ��3Fe2++4H++NO3-=3Fe3++NO��+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ�������ᡢ�ڴ��ᡢ���������ơ����Ȼ�李��ݴ���李���������李��߰�ˮ����ش��������⣺
��1���١��ڡ��ۡ���������Һ����ˮ�������H��Ũ���ɴ�С��˳����(�����)___________��
��2���ܡ��ݡ��ޡ���������Һ��NH![]() Ũ���ɴ�С��˳����(�����)_______________��
Ũ���ɴ�С��˳����(�����)_______________��
��3�����ۺܰ͢������1��2��Ϻ��Һ�и�����Ũ���ɴ�С��˳���ǣ�__________________��
��4����֪t ��ʱ��KW��1��10��13����t ��(�����������������)________25�档��t ��ʱ��pH��11��NaOH��Һa L��pH��1��H2SO4��Һb L���(���Ի�Ϻ���Һ����ı仯)�������û����Һ��pH��2����a��b��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ�������
A.̼��12 ԭ�Ӻ�̼��13 ԭ�ӵ���������ͬ
B.KMnO4 �� K2 MnO4 ������ͬ��ԭ����
C.Fe2+�� Fe3+��������Ԫ�أ������������ͬ
D. ��
�� ��ѧ��������
��ѧ��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com