
【题目】已知A→C必须加热,否则会发生钝化现象。请回答下列问题:
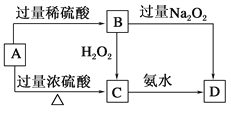
(1)A是________,你推断的理由是___________________。
(2)B在酸性条件下与H2O2反应的离子方程式:_____________________。
(3)A与过量浓H2SO4反应的化学方程式:_______________________。
【答案】 铁 A在浓硫酸中会钝化,且A与浓硫酸与稀硫酸反应的氧化产物不同 2H++2Fe2++H2O2===2H2O+2Fe3+ 6H2SO4(浓)+2Fe═Fe2(SO4)3+3SO2↑+6H2O
【解析】已知A→C必须加热,否则会发生钝化现象,则A为铁或铝,根据流程图,A与稀硫酸和浓硫酸反应生成不同的产物,其中B能够氧化生成C,则A为铁B为亚铁盐,C为铁盐。
(1) A在浓硫酸中会钝化,且A与浓硫酸与稀硫酸反应的氧化产物不同,因此A是铁,故答案为:铁;A在浓硫酸中会钝化,且A与浓硫酸与稀硫酸反应的氧化产物不同;
(2)硫酸亚铁在酸性条件下与H2O2反应被氧化为铁离子,反应的离子方程式为2H++2Fe2++H2O2===2H2O+2Fe3+,故答案为:2H++2Fe2++H2O2===2H2O+2Fe3+;
(3)铁与过量浓H2SO4反应生成硫酸铁、二氧化硫和水,反应的化学方程式为6H2SO4(浓)+2Fe═Fe2(SO4)3+3SO2↑+6H2O,故答案为:6H2SO4(浓)+2Fe═Fe2(SO4)3+3SO2↑+6H2O。


科目:高中化学 来源: 题型:
【题目】(1)除去NaCO3粉末中混入的NaHCO3杂质用__________方法,化学方程式为____。
(2)除去氧化铜粉末中混入的氧化铝粉末通常用________试剂,离子方程式为________。
(3)通常用________试剂除去CO2中的HCl气体,离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厌氧性硫酸盐还原菌(SRB)是导致金属微生物腐蚀最为普遍的菌种,铸铁管的一种腐蚀图解如图所示。下列说法正确的是
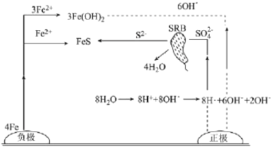
A.生成1molFeS,负极质量增加32g
B.正极区溶液的pH变小
C.正极电极反应式为:8H++8e-=8H·(吸附)、SO42-+8H·(吸附)+8e-![]() S2-+4H2O
S2-+4H2O
D.总反应:4Fe+4H2O+SO42-![]() FeS+3Fe(OH)2+2OH-
FeS+3Fe(OH)2+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A.实验室常用排饱和食盐水的方法收集氯气
B.合成氨反应中,为提高氢气的转化率,理论上应采取加压的措施
C.对于2HI(g) ![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
D.反应CO(g)+NO2(g) ![]() CO2(g)+NO(g) △H<0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g) △H<0,达平衡后,升高温度体系颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种重要的化工原料和燃料,常见合成乙醇的途径如下:
(1)乙烯气相直接水合法:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=akJ·mol-1
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1,则a=__。
(2)工业上常采用CO2和H2为原料合成乙醇,某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
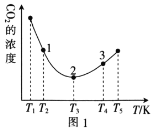
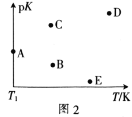
①由图1可知,b=__(填“![]() ”“
”“![]() ”或“<”)0。
”或“<”)0。
②在T1~T2及T4~T5两个温度区间内,容器中CO2(g)的浓度呈现如图1所示的变化趋势,其原因是___。
③图1中点1、2、3对应的逆反应速率v1、v2、v3中最大的是___(填“v1”“v2”或“v3”);要进一步提高H2(g)的转化率,可采取的措施有___(任答一条)。
④图2中当温度为T1时,pK的值对应A点,则B、C、D、E四点中表示错误的是__。
⑤乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g)![]() CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“
CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“![]() ”“
”“![]() ”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是
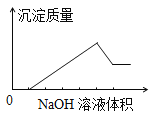
A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为2L且固定的密闭容器中充入2 molSO2和1 molO2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,第一次反应达到平衡时共放出热量176.4kJ,此时再向容器中充入2 molSO2和1 molO2,达到新平衡,则下列说法正确的是
2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,第一次反应达到平衡时共放出热量176.4kJ,此时再向容器中充入2 molSO2和1 molO2,达到新平衡,则下列说法正确的是
A.该温度下,此反应的平衡常数为810
B.若使用高效催化剂,第一次达到平衡时放出热量大于176.4kJ
C.第一次反应达到平衡时,容器内压强为0.7p
D.若降低容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。
(1)汽车尾气中的CO、NOx、碳氢化合物是大气污染物。
①使用稀土等催化剂能将CO、NO转化成无毒物质。
已知:N2(g)+O2(g)=2NO(g) ΔH1=+180.5 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-221 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ·mol-1
写出NO(g)与CO(g)催化转化成N2(g)和CO2(g)的热化学方程式:_____________________。
②醛类、O3、PAN(过氧硝酸乙酰)等污染物气体和颗粒物所形成的烟雾称为光化学烟雾。某研究性学习小组为模拟光化学烟雾的形成,用紫外线照射装在密闭容器内的被污染空气样品,所得物质的浓度随时间的变化如图1所示。请你根据光化学烟雾的形成原理,对减少光化学烟雾的发生提出一个合理建议:________________________________。
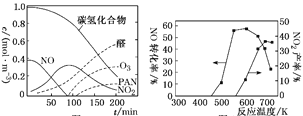
图1 图2
(2)利用NH3催化还原氮氧化物(SCR技术)是目前应用广泛的烟气脱硝技术。SCR技术的主要反应之一为4NO(g)+4NH3(g)+O2(g) ![]() 4N2(g)+6H2O(g)ΔH=-1627.2 kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700 ℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是__________________________。(用化学方程式表达)
4N2(g)+6H2O(g)ΔH=-1627.2 kJ·mol-1。NO和NH3在有氧条件及Ag2O催化作用下,当反应温度升高到550~700 ℃,NO转化率明显下降,NO2产率明显上升(见图2)的可能原因是__________________________。(用化学方程式表达)
(3)目前,科学家还在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如图3,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图4所示。
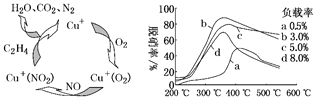
图3 图4
①写出该脱硝原理总反应的化学方程式_____。(已知NO与C2H4体积比为3:1)
②为达到最佳脱硝效果,应选择的条件是_________________________________。
(4)NO(g)与CO(g)催化转化成N2(g)和CO2(g)的反应达到平衡后,20min时,若改变反应条件,导致N2浓度发生如下图5所示的变化,则改变的条件可能是________(填字母)。
A.加入催化剂 B.降低温度 C.增加CO2的量 D.缩小容器体积
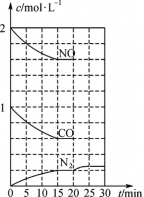
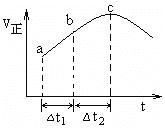
图5 图6
(5)在一定条件下,将SO2和NO2通入绝热恒容密闭容器中,发生反应:SO2(g)+NO2(g) ![]() SO3(g) +NO(g),正反应速率随时间变化如图6所示。由图可得出的正确结论是___(填字母)
SO3(g) +NO(g),正反应速率随时间变化如图6所示。由图可得出的正确结论是___(填字母)
A.反应在c点达到平衡状态
B.反应物浓度:b点小于c点
C.反应物的总能量低于生成物的总能量
D.△t1=△t2时,SO2的转化率:a~b段小于b~c段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁的用途广泛,可以制备下图所示物质,下列说法错误的是( )
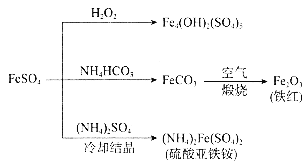
A.![]() 属于碱式盐,可用作净水剂
属于碱式盐,可用作净水剂
B.与足量![]() 反应的离子方程式为:
反应的离子方程式为:![]()
C.可用稀硫酸和![]() 溶液检验铁红中是否含有
溶液检验铁红中是否含有![]()
D.“冷却结晶”后的操作是过滤,“煅烧”操作的主要仪器有酒精灯、蒸发皿、玻璃棒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com