
【题目】乙醇是一种重要的化工原料和燃料,常见合成乙醇的途径如下:
(1)乙烯气相直接水合法:C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=akJ·mol-1
已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1,则a=__。
(2)工业上常采用CO2和H2为原料合成乙醇,某实验小组将CO2(g)和H2(g)按1:3的比例置于一恒容密闭容器中发生反应:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
C2H5OH(g)+3H2O(g) ΔH=bkJ·mol-1。在相同的时间内,容器中CO2的浓度随温度T的变化如图1所示,上述反应的pK(pK=-lgK,K表示反应平衡常数)随温度T的变化如图2所示。
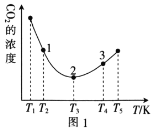
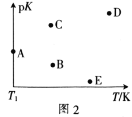
①由图1可知,b=__(填“![]() ”“
”“![]() ”或“<”)0。
”或“<”)0。
②在T1~T2及T4~T5两个温度区间内,容器中CO2(g)的浓度呈现如图1所示的变化趋势,其原因是___。
③图1中点1、2、3对应的逆反应速率v1、v2、v3中最大的是___(填“v1”“v2”或“v3”);要进一步提高H2(g)的转化率,可采取的措施有___(任答一条)。
④图2中当温度为T1时,pK的值对应A点,则B、C、D、E四点中表示错误的是__。
⑤乙烯气相直接水合法过程中会发生乙醇的异构化反应:C2H5OH(g)![]() CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“
CH3OCH3(g) ΔH=+50.7kJ·mol-1,该反应的速率方程可表示为v正=k正c(C2H5OH)和v逆=k逆c(CH3OCH3),k正和k逆只与温度有关。该反应的活化能Ea(正)__(填“![]() ”“
”“![]() ”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
”或“<”) Ea(逆),已知:T℃时,k正=0.006s-1,k逆=0.002s-1,该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚,此时反应__(填“正向”或“逆向”)进行。
【答案】-44.5 < T1~T2区间,化学反应未达到平衡,反应正向进行,温度越高,反应速率越快,所以CO2的浓度随温度的升高而减小;T3以后曲线上对应的点均达到平衡,该反应的正反应是放热反应,温度升高,平衡逆向移动,CO2的浓度随温度的升高而增大 v3 提高CO2的浓度或适当降温或及时移出生成物 BE > 正向
【解析】
(1) 已知:I:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g) ΔH2=-1323.0kJ·mol-1
II:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-1278.5kJ·mol-1;
根据盖斯定律I-II可得C2H4(g)+H2O(g)=C2H5OH(g) ΔH1=ΔH2-ΔH3=(-1323.0kJ·mol-1)-(-1278.5kJ·mol-1)=-44.5 kJ·mol-1;
(2)①据图可知当温度低于T3时随温度上升,CO2的浓度下降,而温度高于T3时随温度上升,CO2的浓度上降,说明相同时间内温度低于T3时反应没有达到平衡,而温度高于T3时,该时段内反应达到平衡,且温度上升平衡左移CO2的浓度上降,所以正反应为放热反应,所以b<0;
②T1~T2区间,化学反应未达到平衡,反应正向进行,温度越高,反应速率越快,所以CO2的浓度随温度的升高而减小;T3以后曲线上对应的点均达到平衡,该反应的正反应是放热反应,温度升高,平衡逆向移动,CO2的浓度随温度的升高而增大;
③温度越高反应速率越快,所以逆反应速率最大的是v3;提高CO2的浓度或及时移出生成物,平衡都可以正向移动增大氢气的转化率,该反应正反为放热反应,适当降低温度也可以提高提高氢气的转化率;
④该反应为放热反应,所以温度越高平衡常数越小,则pK越大,所以BE二点表示错误;
⑤该反应焓变大于0,焓变=正反应活化能-逆反应活化能>0,所以Ea(正)> Ea(逆);反应达到平衡时正逆反应速率相等,即v正=k正c(C2H5OH)=v逆=k逆c(CH3OCH3),所以有![]() ,T℃时,k正=0.006s-1,k逆=0.002s-1,所以该温度下平衡常数K=
,T℃时,k正=0.006s-1,k逆=0.002s-1,所以该温度下平衡常数K=![]() =3,该反应前后气体系数之和相等,所以可以用物质的量代替浓度计算浓度商和平衡常数, 所以该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚时,浓度商Q=
=3,该反应前后气体系数之和相等,所以可以用物质的量代替浓度计算浓度商和平衡常数, 所以该温度下向某恒容密闭容器中充入1.5mol乙醇和4mol甲醚时,浓度商Q=![]() <3,所以此时反应正向移动。
<3,所以此时反应正向移动。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
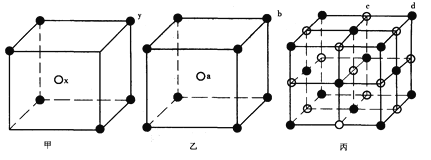
【题目】现有甲、乙、丙(如下图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备N2H4·H2O(水合肼)和无水Na2SO3主要实验流程如下:

已知:① 氯气与烧碱溶液的反应是放热反应;
② N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
⑴从流程分析,本流程所用的主要有机原料为_______________(写名称)。
⑵步骤Ⅰ制备NaClO溶液时,若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,该反应的离子方程式为____________________。
⑶实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,还可采取的措施是_________________。
⑷步骤Ⅱ合成N2H4·H2O(沸点约118 ℃)的装置如图。NaClO碱性溶液与尿素[CO(NH2)2](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。

① 使用冷凝管的目的是_________________。
② 滴液漏斗内的试剂是_______;
将滴液漏斗内的液体放入三颈烧瓶内的操作是______________________________;
③ 写出流程中生成水合肼反应的化学方程式________________________________。
⑸ 步骤Ⅳ制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图所示)。

① 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的pH值为____(取近似整数值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH应控制在________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbSO4的工艺流程如图:
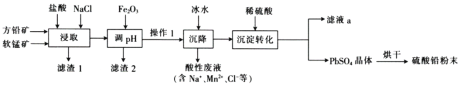
已知:i.PbCl2难溶于冷水,易溶于热水。
ii.PbCl2(s)+2Cl-(aq)![]() PbCl42-(aq) ΔH>0
PbCl42-(aq) ΔH>0
iii.Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5。
(1)“浸取”时需要加热,此时盐酸与MnO2、PbS发生反应生成PbCl2和S的化学方程式为__。
(2)“调pH”的目的是__。
(3)“沉降”操作时加入冰水的作用是__。
(4)![]() 时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。
时,PbCl2(s)在不同浓度的盐酸中的最大溶解量(g·L-1)如图所示。下列叙述正确的是__(填字母)。

A.盐酸浓度越小,Ksp(PbCl2)越小
B.x、y两点对应的溶液中c(Pb2+)不相等
C.当盐酸浓度为1mol·L-1时,溶液中c(Pb2+)一定最小
D.当盐酸浓度小于1mol·L-1时,随着HCl浓度的增大,PbCl2溶解量减小是因为Cl-浓度增大使PbCl2溶解平衡逆向移动
(5)PbCl2经“沉淀转化”后得到PbSO4,当c(Cl-)=0.1mol·L-1时,c(SO42-)=__。
(6)“滤液a”经过处理后可以返回到__工序循环使用。利用制备的硫酸铅与氢氧化钠反应制备目前用量最大的热稳定剂三盐基硫酸铅(3PbO·PbSO4·H2O),该反应的化学方程式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A→C必须加热,否则会发生钝化现象。请回答下列问题:
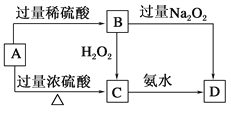
(1)A是________,你推断的理由是___________________。
(2)B在酸性条件下与H2O2反应的离子方程式:_____________________。
(3)A与过量浓H2SO4反应的化学方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以V2O5为原料制备氧钒(Ⅳ)碱式碳酸铵晶体{(NH4)5[(VO)6(CO3)4(OH)9] ·10H2O},其流程如图:
V2O5![]() VOCl2溶液
VOCl2溶液![]() 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
(1)“还原”过程中的还原剂是__(填化学式)。
(2)已知VO2+能被O2氧化,“转化”可在如图装置中进行。

①仪器M的名称是__,实验开始前的操作是__。
②装置B的作用是__。
③加完VOCl2溶液后继续搅拌一段时间,使反应完全,再进行下列操作,顺序为__(填字母)。
a.锥形瓶口塞上橡胶塞
b.取下P
c.将锥形瓶置于干燥器中,静置过滤
④得到紫红色晶体,抽滤,并用饱和NH4HCO3溶液洗涤3次,用无水乙醇洗涤2次,再用乙醚洗涤2次,抽干称重。用饱和NH4HCO3溶液洗涤除去的阴离子主要是__(填离子符号),用无水乙醇洗涤的目的是__。
⑤称量mg产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入0.02mol·L-1KMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用cmol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(已知滴定反应为VO2++Fe2++2H+=VO2++Fe3++H2O),消耗标准溶液的体积为VmL。若(NH4)2Fe(SO4)2标准溶液部分变质,会使测定结果___(填“偏高”“偏低”或“无影响”),产品中钒的质量分数为__(以VO2+的量进行计算,列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是( )
A.对比②③,可以判定Zn保护了Fe
B.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
C.验证Zn保护Fe时不能用①的方法
D.对比①②,K3[Fe(CN)6]可能将Fe氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列操作和现象所得到的结论正确的是( )
操作和现象 | 结论 | |
A | 向碳酸钙中加入盐酸,产生的气体经饱和碳酸氢钠溶液洗气后,再通入硅酸钠溶液,出现白色沉淀 | 利用该实验可以证明非金属性: |
B | 取少量某硫酸盐样品溶于氢氧化钠溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝 | 样品为硫酸铵 |
C | 向 等体积等浓度稀硫酸中分别加入少许等物质的量的 |
|
D | 加热石油分馏得 到的石蜡,将产生的气体通入酸性高锰酸钾溶液中,溶液颜色逐渐褪去 | 石油中含有烯烃 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com