
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的悬浊液中逐滴加入1 mol·L-1 HCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示,试回答:
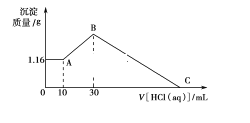
(1)A点→B点反应的离子方程式为____________________________________。
(2)原混合物中AlCl3的物质的量为________________,NaOH的物质的量为___________________。
(3)HCl溶液在C点的加入量是_______________________。
【答案】H2O+AlO2-+H+=Al(OH)3↓ 0.02mol 0.13 mol 130mL
【解析】
从图中可以看出,先加入的10mLHCl用于中和过量的NaOH,1.16 g白色沉淀为Mg(OH)2;在AB段,HCl与NaAlO2发生反应,生成Al(OH)3沉淀;BC段,HCl与Mg(OH)2、Al(OH)3发生反应,生成MgCl2、AlCl3等。
(1)由以上分析可知,A点→B点,HCl与NaAlO2发生反应,生成Al(OH)3沉淀。
(2)原混合物中AlCl3的物质的量等于NaAlO2的物质的量,也等于20mLHCl的物质的量,NaOH的物质的量=过量的NaOH物质的量+与MgCl2反应的NaOH的物质的量+与AlCl3反应生成NaAlO2的NaOH的物质的量。
(3) 在C点,HCl全部转化为NaCl,则HCl的物质的量=NaOH的物质的量。
(1)由以上分析可知,A点→B点,发生反应HCl+NaAlO2+H2O=Al(OH)3↓+NaCl,离子方程式为H2O+AlO2-+H+=Al(OH)3↓。答案为:H2O+AlO2-+H+=Al(OH)3↓;
(2)n(AlCl3)=n(HCl)=1mol/L×0.02L=0.02mol;
固体溶于水后,发生的反应为:Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,n[Mg(OH)2]=![]() =0.02mol,n(NaOH)=n(NaOH)(剩余)+2n[Mg(OH)2]+4n(AlO2-)=1mol/L×0.01L+0.02mol×2+0.02L×1mol/L×4=0.13mol;答案为:0.02mol;0.13 mol;
=0.02mol,n(NaOH)=n(NaOH)(剩余)+2n[Mg(OH)2]+4n(AlO2-)=1mol/L×0.01L+0.02mol×2+0.02L×1mol/L×4=0.13mol;答案为:0.02mol;0.13 mol;
(3) 在C点,n(HCl) =n(NaOH)=0.13mol,V(HCl)=![]() =0.13L=130mL。
=0.13L=130mL。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将二氧化钛(TiO2)光电极嵌入到新型钠离子电池的正极,由于光电势的补偿,电池的充电电位下降。该光电极辅助充电时的工作原理如图所示,下列说法错误的是

A.充电时阳极的电极反应式为3I--2e-=I3-
B.放电时,a极发生氧化反应
C.放电时,正、负极反应的微粒数目比为4:3
D.辅助充电时,光能转化为电能,再转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙、丙(如下图)三种晶体的晶胞(甲中x处于晶胞的中心,乙中a处于晶胞的中心),可推知:甲晶胞中x与y的个数比是__________,乙晶胞中a与b的个数比是__________,丙晶胞中有________个c离子,有________个d离子。
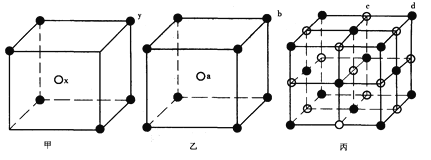
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2X+Y![]() 2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是
2Z,反应中ω(Z的物质的量分数)随温度T的变化如下图所示。下列判断正确的是

A. T1时,v正>v逆
B. 正反应的△H<0
C. a、b两点的反应速率va=vb
D. T<T1时,ω增大的原因是平衡向正方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量。经测定,加入的NaOH的物质的量(mol)和所得沉淀的物质的量(mol)的关系如下图所示。
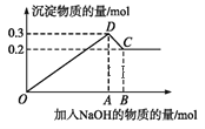
(1)写出下列线段内发生反应的离子方程式:
OD段_________________________,
CD段_________________________。
(2)原溶液中Mg2+、Al3+的物质的量浓度之比为____________。
(3)图中C点横坐标为_______ 。
(4)图中线段OA∶AB=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,CH3COOH和NH3·H2O的电离常数相等。
(1)25 ℃时,取10mL0.1mol·L-1醋酸溶液测得其pH=3。0.1mol·L-1氨水(NH3·H2O溶液)的pH=___。用pH试纸测定该氨水pH的操作方法为_____。氨水(NH3·H2O溶液)电离平衡常数表达式Kb=____,25℃时,氨水电离平衡常数约为_____。
(2)25℃时,现向10mL0.1mol·L-1氨水中滴加相同浓度的CH3COOH溶液,在滴加过程中![]() ___(填序号)。
___(填序号)。
a.始终减小 b.始终增大 c.先减小再增大 d.先增大后减小
(3)某温度下,向V1mL0.1mol·L-1NaOH溶液中逐滴加入等浓度的醋酸溶液,溶液中pOH与pH的变化关系如图。已知:pOH=-lgc(OH-)。
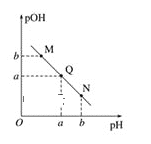
图中M、Q、N三点所示溶液呈中性的点是____(填字母,下同)。图中M、Q、N三点所示溶液中水的电离程度最大的点是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备N2H4·H2O(水合肼)和无水Na2SO3主要实验流程如下:

已知:① 氯气与烧碱溶液的反应是放热反应;
② N2H4·H2O有强还原性,能与NaClO剧烈反应生成N2。
⑴从流程分析,本流程所用的主要有机原料为_______________(写名称)。
⑵步骤Ⅰ制备NaClO溶液时,若温度为41℃,测得产物中除NaClO外还含有NaClO3,且两者物质的量之比为5∶1,该反应的离子方程式为____________________。
⑶实验中,为使步骤Ⅰ中反应温度不高于40 ℃,除减缓Cl2的通入速率外,还可采取的措施是_________________。
⑷步骤Ⅱ合成N2H4·H2O(沸点约118 ℃)的装置如图。NaClO碱性溶液与尿素[CO(NH2)2](沸点196.6℃)水溶液在40℃以下反应一段时间后,再迅速升温至110℃继续反应。

① 使用冷凝管的目的是_________________。
② 滴液漏斗内的试剂是_______;
将滴液漏斗内的液体放入三颈烧瓶内的操作是______________________________;
③ 写出流程中生成水合肼反应的化学方程式________________________________。
⑸ 步骤Ⅳ制备无水Na2SO3(水溶液中H2SO3、HSO3-、SO32-随pH的分布如图所示)。

① 边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定停止通SO2的pH值为____(取近似整数值,下同);
②用制得的NaHSO3溶液再制Na2SO3溶液的pH应控制在________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是( )
A.对比②③,可以判定Zn保护了Fe
B.将Zn换成Cu,用①的方法可判断Fe比Cu活泼
C.验证Zn保护Fe时不能用①的方法
D.对比①②,K3[Fe(CN)6]可能将Fe氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com