
【题目】100 mL 0.5 mol/L碳酸钠溶液和100 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则关于盐酸的浓度可能是( )
A.0.25 mol/LB.0.5 mol/LC.0.75 mol/LD.1 mol/L
【答案】C
【解析】
碳酸钠滴入盐酸中时发生CO32﹣+2H+═H2O+CO2↑,盐酸滴入碳酸钠溶液时,依次发生反应:CO32﹣+H+═HCO3﹣、HCO3﹣+H+═H2O+CO2↑,不管是将前者加入后者中,还是将后者加入前者中,都有气体产生,说明n(HCl):n(Na2CO3)>1:1,但最终产生的气体体积不同,说明n(HCl):n(Na2CO3)<2:1,据此进行计算。
当把碳酸钠滴入盐酸中时发生CO32﹣+2H+═H2O+CO2↑,当把盐酸滴入碳酸钠溶液时,依次发生反应:CO32﹣+H+═HCO3﹣、HCO3﹣+H+═H2O+CO2↑,不管是将前者加入后者中,还是将后者加入前者中,都有气体产生,说明n(HCl):n(Na2CO3)>1:1,但最终产生的气体体积不同,说明n(HCl):n(Na2CO3)<2:1.而n(Na2CO3)=0.1L×0.5mol/L=0.05mol,则0.05mol<n(HCl)<0.1mol,盐酸的体积是100mL,所以![]() <c(HCl)<
<c(HCl)<![]() ,即0.5mol/L<c(HCl)<1mol/L;
,即0.5mol/L<c(HCl)<1mol/L;
答案选C。


科目:高中化学 来源: 题型:
【题目】工业上冶炼铁的原理为:Fe2O3 +3CO![]() 2Fe+ 3CO2。
2Fe+ 3CO2。
(1)该反应中氧化剂是__(填化学式),碳元素被__(填“氧化”或“还原”)。
(2)若消耗了3molCO,则生成CO2的体积是__L(标准状况),转移电子的物质的量是___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa条件下,C(s)、H2(g)、CH3COOH(l)的标准燃烧热分别为-393.5 kJ/mol、-285.8 kJ/mol、-870.3 kJ/mol,则1/2CH3COOH(l) ═ C(s)+H2(g)+1/2O2(g)的反应热为( )
A. +244.15 kJ/molB. +488.3 kJ/molC. -191 kJ/molD. +191 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关钠及其化合物的有关说法中正确的是( )
A.钠与CuSO4溶液反应的离子方程式为2Na+Cu2+═Cu+2Na+
B.7.8 g Na2O2含离子数为0.4NA
C.“侯氏制碱法”中的碱指NaHCO3
D.向Na2CO3饱和溶液中通入足量的CO2,有NaHCO3结晶析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cr(OH)3是类似Al(OH)3的两性氢氧化物,Ksp[Al(OH)3]=1.3×10-33,Ksp[Cr(OH)3]=6.3×10-31。如图为Cr和Al两种元素在水溶液中存在的形式与pH的关系,图中纵轴表示lgc(M3+)或lgc[M(OH)4-](其中M=Al或Cr)。下列说法错误的是( )
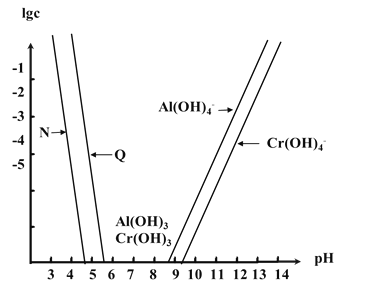
A.曲线N表示Al3+的浓度变化
B.在Al(OH)3和Cr(OH)3混合悬浊液中滴加NaOH溶液,Al(OH)3先溶解
C.在Al(OH)3和Cr(OH)3共沉淀的体系中![]() ≈4.8×102
≈4.8×102
D.若溶液中Al3+和Cr3+起始浓度均为0.1molL-1,通过调节pH能实现两种元素的分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有Fe2O3 、CuO的混合物,在足量H2气流中,加热充分反应,冷却后称得剩余固体比原混合物减轻1.6 g;若将等质量的原混合物与盐酸反应,欲使之完全溶解,需1 mol/L的盐酸的体积至少为( )
A.0.05 LB.0.1 LC.0.2 LD.0.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为充分利用资源,变废为宝,实验室里利用废铁屑制取硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]。某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O42H2O),进一步制备高纯度还原铁粉。
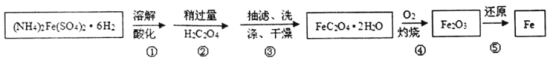
已知:FeC2O42H2O难溶于水,150℃开始失结晶水:H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)步骤②中,H2C2O4稍过量主要原因是_________________。
(2)为了提高步骤③得到的FeC2O42H2O的纯度,宜用_________________(填热水、冷水或无水乙醇)洗涤,检验洗涤是否干净的操作是_________________。
(3)实现步骤④必须用到的两种仪器是_________________(供选仪器:a.烧杯;b. 坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶):
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3, 理由是_________________。
(5)硫酸亚铁铵是重要的工业原料,其溶解性如表所示:
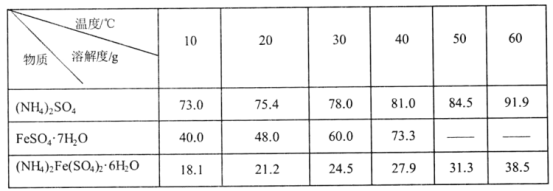
(注意:高于73.3℃,FeSO47H2O发生分解)
以铁屑(有油污)、硫酸、硫酸较为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,_________________冷却,过滤,用蒸馏水洗涤铁屑至中性,将铁屑置于锥形瓶中,_________________至铁屑完全溶解,_________________,冷却结晶,用无水乙醇洗涤2-3次,低温干操。[实验中必须使用的试剂:铁屑、1.0molL-1的Na2CO3溶液、3.0molL-1的H2SO4溶液,饱和(NH4)2SO4溶液]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.56 g Fe在足量Cl2中充分燃烧,转移电子数为2×6.02×1023
B.合成氨反应放热,采用低温可以提高氨的生成速率
C.常温下Na2CO3溶液中加入少量Ca(OH)2固体,溶液中![]() 的值减小
的值减小
D.若电工操作中将铝线与铜线直接相连会导致铜线更快被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加,由这些元素组成的常见物质的转化关系如下图,其中a、b、d、g为化合物,a为淡黄色固体,c是Z的单质,在铝热反应中常做引发剂;f可作电极材料下列有关说法正确的是
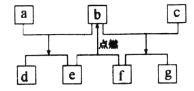
A.简单氢化物的沸点:Y>X
B.简单离子的半径:Y>Z>X
C.阳离子的氧化性:Y>Z
D.b和g所含的化学键类型相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com