
【题目】下列说法正确的是( )
A.56 g Fe在足量Cl2中充分燃烧,转移电子数为2×6.02×1023
B.合成氨反应放热,采用低温可以提高氨的生成速率
C.常温下Na2CO3溶液中加入少量Ca(OH)2固体,溶液中![]() 的值减小
的值减小
D.若电工操作中将铝线与铜线直接相连会导致铜线更快被腐蚀
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH-=ClO-+Cl-+H2O
B.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=[Al(OH)4]-+H2↑
C.室温下用稀HNO3溶解铜:Cu+2NO3-+2H+=Cu2++2NO2↑+H2O
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示:下列叙述正确的是

A.装置e的作用是防倒吸
B.根据图a的现象判断活塞K一定处于关闭状态
C.实验结束时,先关闭活塞K,再熄灭酒精灯
D.b、c、f中的试剂依次为饱和碳酸钠溶液、浓硫酸、银氨溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用氯气和苯反应制少量氯苯,可用如图装置。请回答下列问题:
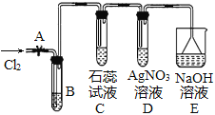
(1)大试管B中装少量铁屑和![]() 试管的苯,将导管伸入试管B底部,打开A,缓缓通入经过净化的氯气,先看到苯呈黄色,片刻后C、D导管口有白雾。B中发生的有机化学反应方程式为_____。B大试管上的长直导管的作用_____。
试管的苯,将导管伸入试管B底部,打开A,缓缓通入经过净化的氯气,先看到苯呈黄色,片刻后C、D导管口有白雾。B中发生的有机化学反应方程式为_____。B大试管上的长直导管的作用_____。
(2)C试管内出现的现象为_____;D试管内出现的现象为____。C、D试管里的导管没有插入溶液中的原因是______。
(3)将导管伸入试管B底部的目的是_____。
(4)反应完成后,将B中的液体倒入装在一定量水的烧杯中,可以得到橙黄色不溶于水的油状液体沉于烧杯底部,通过____操作,可以得到粗氯苯。从粗氯苯中除去溶解的氯气,用NaOH溶液处理后再洗涤,反应的离子方程式为____。
(5)本实验____(是或否)可以证明氯气和苯的反应是取代反应而不是加成反应,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.SO2与Ba(NO3)2反应生成BaSO3
B.NH3在纯O2中燃烧生成NO2
C.过量CO2与氨水反应生成NH4HCO3
D.高温条件下Fe与水蒸气反应生成Fe(OH)3和H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见物质A、B、C、D、E、X,存在下图转化关系 (部分生成物和反应条件略去)。下列推断不正确的是( )
![]()
A. 若D是一种强碱,则A、B、C均可与X反应生成D
B. 若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
C. 若D为NaCl,且A可与C反应生成B,则E可能是CO2
D. 若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd +2NiOOH + 2H2O![]() Cd(OH)2 +2Ni(OH)2,有关该电池的说法正确的是
Cd(OH)2 +2Ni(OH)2,有关该电池的说法正确的是
A. 充电时阳极反应:Ni(OH)2-e—+OH-==NiOOH+H2O
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性不变
D. 放电时电解质溶液中的OH-向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应K值______,二氧化硫转化率____,化学反应速度____ ,(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_____。

(3)据图判断,反应进行至20min时,曲线发生变化的原因_____(用文字表达)
(4)10min到15min的曲线变化的原因可能是____(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是典型的可充型电池,起反应为Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O:,下列说法正确的是
2PbSO4+2H2O:,下列说法正确的是
A. 放电时负极质量减少,正极质量增加,电解质溶液中H2SO4的浓度将变小
B. 放电时负极的电极反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O
C. 充电时Pb与电源正极相连
D. 充电时阳极上pbSO4变为PbO2,发生氧化反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com