
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd +2NiOOH + 2H2O![]() Cd(OH)2 +2Ni(OH)2,有关该电池的说法正确的是
Cd(OH)2 +2Ni(OH)2,有关该电池的说法正确的是
A. 充电时阳极反应:Ni(OH)2-e—+OH-==NiOOH+H2O
B. 充电过程是化学能转化为电能的过程
C. 放电时负极附近溶液的碱性不变
D. 放电时电解质溶液中的OH-向负极移动
【答案】AD
【解析】
放电时负极上发生的电极反应式为:Cd-2e—+2OH-== Cd(OH)2,正极上发生的电极反应式为:NiOOH+e-+H2O═Ni(OH)2+OH-,充电时阳极上发生的电极反应式为:Ni(OH)2-e—+OH-==NiOOH+H2O,阴极上发生的电极反应式为:Cd(OH)2+2e-═Cd+2OH-,放电时,溶液中氢氧根离子向负极移动,电解池是把电能转变为化学能的装置。
A.充电时,阳极上失电子发生氧化反应,电极反应式为Ni(OH)2-e—+OH-==NiOOH+H2O,故A正确;
B.充电时,该装置是电解池,是将电能转化为化学能的过程,故B错误;
C.放电时,负极反应式为Cd-2e—+2OH-== Cd(OH)2,负极上消耗氢氧根离子,溶液的pH减小,故C错误;
D,放电时,阴离子向负极移动,则电解质溶液中氢氧根离子向负极Cd移动,故D正确;
答案选AD。


科目:高中化学 来源: 题型:
【题目】已知反应式:mX(g)+nY(?)![]() pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的
pQ(s)+2mZ(g),已知反应已达平衡,此时c(X)=0.3mol/L,其他条件不变,若容器缩小到原来的![]() ,c(X)=0.5mol/L,下列说法正确的是( )
,c(X)=0.5mol/L,下列说法正确的是( )
A.反应向逆方向移动B.Y可能是固体或液体
C.系数n>mD.Z的体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
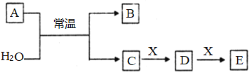
(1)若A为常见的金属单质,且其焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:___________________________________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则X可能为__________(填字母)。
a. NaHCO3 b. Na2CO3 c.Al(OH)3 d.NaAlO2
(3)若A为淡黄色粉末,则A的电子式为_______ 。若X为一种最常见的造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为___。(填字母)
a.盐酸 b.CaCl2溶液 c.氨水 d.澄清石灰水
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。则A与水反应的化学方程式中氧化剂与还原剂的物质的量之比为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.56 g Fe在足量Cl2中充分燃烧,转移电子数为2×6.02×1023
B.合成氨反应放热,采用低温可以提高氨的生成速率
C.常温下Na2CO3溶液中加入少量Ca(OH)2固体,溶液中![]() 的值减小
的值减小
D.若电工操作中将铝线与铜线直接相连会导致铜线更快被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g)2CO(g)+2H2(g)。在特定温度下,向甲、乙、丙三个密闭容器中充入相同量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如下表所示:
实验编号 | 容器温度/℃ | 容器体积 | 物质浓度/(mol·L-1) | ||
CH4 | CO2 | CO | |||
甲 | 300 | V1 | 0.02 | 0.02 | 0.10 |
乙 | 300 | V2 | x | x | 0.05 |
丙 | 350 | V1 | y | y | 0.12 |
下列说法正确的是( )
A.该反应在低温条件下不能自发进行
B.300 ℃时反应的平衡常数为25
C.V1∶V2=3∶7
D.保持温度和容器体积不变,开始时向甲容器中充入0.28 mol CO和0.28 mol H2,CO转化率一定大于2/7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作能使100mLc(H+)=1mol·L-1的盐酸变成c(HCl)=2mol·L-1的是( )
A.加热蒸发至50mL溶液
B.加入3mol·L-1盐酸100mL
C.加入4mol·L-1盐酸100mL后稀释至250mL
D.通入4.48L HCl气体并稀释到200mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的 乙炔气体中往往含有少量的 H2S 和PH3气体,请按下列要求填空:

(1)实验室制乙炔的化学方程式是:_________________;为了得到较为平稳的乙炔气流, 装置 A 的分液漏斗中常用______________来代替水.
(2)装置 B 中CuSO4溶液的作用是_______________________________.
(3)装置 D 中观察到的现象是 ___________________________________________
(4)若称取m g 电石,反应完全后,生成的乙炔n g,则CaC2的纯度为_____(用m与n表示)。
(5)写出以乙炔和HCl为原料,合成聚氯乙烯的方程式是________________,___________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来AIST报告正在研制一种“高容量、低成本”的锂-铜空气燃料电池,该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为:2Li+Cu2O+H2O═2Cu+2Li++2OH-,下列说法正确的是
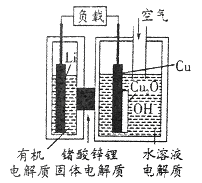
A. 正极为Li,负极为Cu
B. 放电时,正极的电极反应为:2Cu+2OH-+2e-==Cu2O+2H2O
C. Li极有机电解质可以换成Cu极的水溶液电解质
D. 通空气时,整个反应过程中,铜相当于催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com