
����Ŀ��ʵ����������ͼ��ʾװ�����Ʊ���Ȳ������֤��Ȳ��ijЩ��ѧ���ʣ��Ʊ��� ��Ȳ�������������������� H2S ��PH3���壬�밴����Ҫ����գ�

(1)ʵ��������Ȳ�Ļ�ѧ����ʽ�ǣ�_________________��Ϊ�˵õ���Ϊƽ�ȵ���Ȳ������ װ�� A �ķ�Һ©���г���______________������ˮ��
(2)װ�� B ��CuSO4��Һ��������_______________________________��
(3)װ�� D �й۲쵽�������� ___________________________________________
(4)����ȡm g ��ʯ����Ӧ��ȫ�����ɵ���Ȳn g����CaC2�Ĵ���Ϊ_____(��m��n��ʾ)��
(5)д������Ȳ��HClΪԭ�ϣ��ϳɾ�����ϩ�ķ���ʽ��________________��___________________ ��
���𰸡�CaC2+2H2O��CH��CH��+Ca(OH)2 ����ʳ��ˮ ��ȥ H2S��PH3 ���ʣ��Է����ź���ʵ�� ��ɫ���Ϻ�ɫ��ȥ 32n/13m CH![]() CH + HCl
CH + HCl![]()
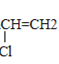

��������
�����л�������Ľṹ�����ʷ�����𣻸�����Ȳ���Ʊ�����������𣻸������ʵ��Ʊ������롢�ᴿ���֪ʶ�������
(1)ʵ�����Ʊ���Ȳ�����õ�ʯ��ˮ��Ӧ������Ȳ����������,��Ӧ�Ļ�ѧ����ʽΪ��CaC2+2H2O��CH��CH��+Ca(OH)2��̼������ˮ��Ӧ�ܾ��ң��ñ���ʳ��ˮ���Լ�����Ӧ������Ϊ�˵õ�ƽ�ȵ��������ñ���ʳ��ˮ����ˮ��
�ʴ�Ϊ�� CaC2+2H2O��CH��CH��+Ca(OH)2������ʳ��ˮ��
(2) ����������л�ԭ�ԣ�Ҳ�ᵼ����ˮ�����������Һ��ɫ��װ��B��CuSO4��Һ�������dz�ȥ��Ȳ�е������PH3��Cu2++H2S=CuS��+2H+����ֹ���ź�������ʵ�飻
�ʴ�Ϊ����ȥ H2S��PH3 ���ʣ��Է����ź���ʵ�飻
(3) ��Ȳͨ�����������Һ����Ȳ���в����ͼ��������������Һ�������ɶ�����̼��װ��D�й۲쵽����������Һ��ɫ�������ķ�ӦΪ������Ӧ��
�ʴ�Ϊ����ɫ��ȥ��
(4)n(C2H2)=![]() mol�����ݷ���ʽ�л�ѧ������ϵ��֪��n(CaC2)= n(C2H2)=
mol�����ݷ���ʽ�л�ѧ������ϵ��֪��n(CaC2)= n(C2H2)=![]() mol����m(CaC2)= n(CaC2)��64g/mol=
mol����m(CaC2)= n(CaC2)��64g/mol=![]() ��̼���ƵĴ���Ϊ��
��̼���ƵĴ���Ϊ��![]() =
=![]() =
=![]() ��
��
�ʴ�Ϊ��![]() ��
��
(5)��Ȳ��HCl�����ӳɷ�Ӧ�õ�����ϩ������ϩ��һ�������·����Ӿ۷�Ӧ���ɾ�����ϩ����ʽΪ��CH![]() CH+HCl��CH(Cl)=CH2��
CH+HCl��CH(Cl)=CH2�� ��
��
�ʴ�Ϊ��CH![]() CH+HCl��CH(Cl)=CH2��
CH+HCl��CH(Cl)=CH2�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����̽��CO2��п����Ӧ�Ƿ�����CO����֪CO����������Һ��Ӧ������ɫ���塣ʵ��װ����ͼ��ʾ������������ȷ����

A.װ��e�������Ƿ�����
B.����ͼa�������жϻ���Kһ�����ڹر�״̬
C.ʵ�����ʱ���ȹرջ���K����Ϩ��ƾ���
D.b��c��f�е��Լ�����Ϊ����̼������Һ��Ũ���ᡢ������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ӣ�Ni-Cd���ɳ�������ִ��������й㷺Ӧ�á���֪ij���ӵ�صĵ������ҺΪKOH��Һ����䡢�ŵ簴��ʽ���У�Cd +2NiOOH + 2H2O![]() Cd(OH)2 +2Ni(OH)2���йظõ�ص�˵����ȷ����
Cd(OH)2 +2Ni(OH)2���йظõ�ص�˵����ȷ����
A. ���ʱ������Ӧ��Ni(OH)2��e��+OH-==NiOOH+H2O
B. �������ǻ�ѧ��ת��Ϊ���ܵĹ���
C. �ŵ�ʱ����������Һ�ļ��Բ���
D. �ŵ�ʱ�������Һ�е�OH-���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���������������������·�Ӧ��2SO2��g��+ O2 (g)![]() 2SO3(g) ��H<0
2SO3(g) ��H<0
��1�������¶ȣ��÷�ӦKֵ______����������ת����____����ѧ��Ӧ�ٶ�____ ,�����Ͼ�������С�䣩
��2��600��ʱ����һ�ܱ������У������������������ϣ���Ӧ������SO2��O2��SO3���ʵ����仯��ͼ����Ӧ����ƽ��״̬��ʱ����_____��

��3����ͼ�жϣ���Ӧ������20minʱ�����߷����仯��ԭ��_____�������ֱ��
��4��10min��15min�����߱仯��ԭ�������____����д��ţ���
a�����˴��� b����С������� c�������¶� d������SO3�����ʵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ���ͼ�жϣ�����˵����ȷ���ǣ���

A.װ������װ�����и�����Ӧ����Fe��2e��=Fe2+
B.װ������������Ӧ��O2��2H2O��4e��=4OH��
C.װ������װ�����������е������Ӿ����Ҳ��ձ��ƶ�
D.�ŵ�����У�װ��������ձ���װ�����Ҳ��ձ�����Һ��pH�ֱ�����ͼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������г��˼������ʣ��뽫���ʵĺ��������д�ڿո��ϡ�
�� ���ʯ��ʯī�� ������ʹ���
�� 16O��18O�� ��CH3CH3��CH3CH2CH3��
��![]() ��
��
(1)ͬ������______________________________��
(2)ͬλ��_________________________��
(3)ͬ��������______________________________��
(4)ͬϵ��__________________________��
(5)ͬ���칹��______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������� �ķ���ʽ��ΪC5H8O2������˵����ȷ���ǣ�������
�ķ���ʽ��ΪC5H8O2������˵����ȷ���ǣ�������
A.x������̼ԭ�Ӿ�λ��ͬһƽ��
B.x��y������NaOH��Һ������Ӧ
C.y��z������![]() ��Ӧ����
��Ӧ����![]()
D.�����ǻ�Ϊͬ���칹�����״������6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ǧ�����ǵ��͵Ŀɳ��͵�أ���ӦΪPb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O��������˵����ȷ����
2PbSO4+2H2O��������˵����ȷ����
A. �ŵ�ʱ�����������٣������������ӣ��������Һ��H2SO4��Ũ�Ƚ���С
B. �ŵ�ʱ�����ĵ缫��ӦΪ��PbO2+2e-+4H++SO42-=PbSO4+2H2O
C. ���ʱPb���Դ��������
D. ���ʱ������pbSO4��ΪPbO2������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�Ͽ� 1mol Cl2(g)��Cl-Cl����Ҫ����243kJ���������������仯ʾ��ͼ������˵�����Ȼ�ѧ����ʽ��ȷ����( )
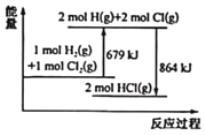
A.H2(g)+Cl2(g) = 2HCl(g) ��H= + 185 kJ��mol-1
B.����1mol H2(g)�е�H-H���ų� 121.5 kJ ����
C.�Ͽ�1mol HCl(g)�е�H-C1��Ҫ���� 864 kJ ����
D.HCl(g) =![]() H2(g)+
H2(g)+![]() Cl2(g) ��H= + 92.5kJ��mol-1
Cl2(g) ��H= + 92.5kJ��mol-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com