
【题目】为充分利用资源,变废为宝,实验室里利用废铁屑制取硫酸亚铁铵[(NH4)2Fe(SO4)26H2O]。某兴趣小组以废铁屑制得硫酸亚铁铵后,按下列流程制备二水合草酸亚铁(FeC2O42H2O),进一步制备高纯度还原铁粉。
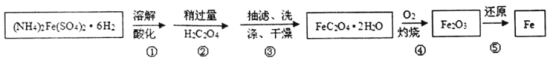
已知:FeC2O42H2O难溶于水,150℃开始失结晶水:H2C2O4易溶于水,溶解度随温度升高而增大。
请回答:
(1)步骤②中,H2C2O4稍过量主要原因是_________________。
(2)为了提高步骤③得到的FeC2O42H2O的纯度,宜用_________________(填热水、冷水或无水乙醇)洗涤,检验洗涤是否干净的操作是_________________。
(3)实现步骤④必须用到的两种仪器是_________________(供选仪器:a.烧杯;b. 坩埚;c.蒸馏烧瓶;d.高温炉;e.表面皿;f.锥形瓶):
(4)为实现步骤⑤,不宜用碳粉还原Fe2O3, 理由是_________________。
(5)硫酸亚铁铵是重要的工业原料,其溶解性如表所示:
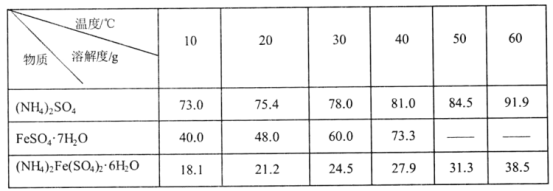
(注意:高于73.3℃,FeSO47H2O发生分解)
以铁屑(有油污)、硫酸、硫酸较为原料,补充制取硫酸亚铁铵晶体的实验方案:将铁屑置于锥形瓶中,_________________冷却,过滤,用蒸馏水洗涤铁屑至中性,将铁屑置于锥形瓶中,_________________至铁屑完全溶解,_________________,冷却结晶,用无水乙醇洗涤2-3次,低温干操。[实验中必须使用的试剂:铁屑、1.0molL-1的Na2CO3溶液、3.0molL-1的H2SO4溶液,饱和(NH4)2SO4溶液]
【答案】使Fe2+反应更加充分,提高其转化率 热水 取最后一次洗涤溶液少许,向其中加入盐酸酸化的氯化钡,若无白色沉淀,则洗涤干净 bd 反应接触不充分或者有C杂质(答对一个即可) 加入1.0mol·L-1的Na2CO3溶液,加热煮沸后 边搅拌边加入3.0mol·L-1的H2SO4溶液至 加入一定量的饱和(NH4)2SO4溶液,低于73.3℃水浴加热,将溶液浓缩到表面有晶膜出现
【解析】
由工艺流程分析可知,(NH4)2Fe(SO4)26H2O溶解酸化后加入稍过量的H2C2O4溶液,得到含FeC2O42H2O的混合溶液,再经过抽滤、洗涤、干燥得到FeC2O42H2O,将FeC2O42H2O在O2气流中灼烧得到Fe2O3,最后还原得到Fe单质,据此结合已知信息分析解答。
(1)硫酸亚铁铵中的Fe2+发生水解,加入稍过量的草酸有助于抑制Fe2+的水解,使反应更加充分,提高草酸亚铁的转化率,故答案为:使Fe2+反应更加充分,提高其转化率;
(2)已知草酸在水中的溶解度随温度的升高而增大,第三步洗涤过程中应用热水,以保证附着在草酸亚铁表面的杂质全部洗净;检验洗涤是否干净的操作过程为:取最后一次洗涤溶液少许,向其中加入盐酸酸化的氯化钡,若无白色沉淀,则洗涤干净,故答案为:热水;取最后一次洗涤溶液少许,向其中加入盐酸酸化的氯化钡,若无白色沉淀,则洗涤干净;
(3)步骤④为高温反应,需用到坩埚和高温炉两种仪器,所以应选bd,故答案为:bd;
(4)利用碳粉还原氧化铁,可能会出现反应不均、生成的Fe中有C杂质混入等情况,故答案为:反应接触不充分或者有C杂质(答对一个即可);
(5)加入1.0 mol·L-1的Na2CO3溶液有助于洗去铁屑表面的油污;加入3.0mol·L-1的H2SO4溶液可以将铁屑反应生成硫酸亚铁;加入饱和(NH4)2SO4溶液直至有晶膜出现保证硫酸亚铁和硫酸铵可以同时析出生成硫酸亚铁氨,反应出超过73.3℃是为了防止FeSO4·7H2O失水,故答案为:加入1.0mol·L-1的Na2CO3溶液,加热煮沸后;边搅拌边加入3.0mol·L-1的H2SO4溶液至;加入一定量的饱和(NH4)2SO4溶液,低于73.3℃水浴加热,将溶液浓缩到表面有晶膜出现。


科目:高中化学 来源: 题型:
【题目】如图是氢氧燃料电池构造示意图。下列说法不正确的是( )

A. a极是负极
B. 电流由b通过灯泡流向a
C. 该电池总反应是2H2+ O2=2H2O
D. b极的电极反应为:O2+2H2O+4e-=4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“生活无处不化学”,请你回答下列问题。
(1)厨房中的调味品,①盐(主要成分氯化钠)、②碱面(主要成分碳酸钠)、③白醋(主要成分乙酸)。主要成分中具有碱性的是_____(填序号,下同);属于盐类的是______;相互间能发生反应的是________。
(2)食盐不慎洒落在天然气的火焰上,观察的现象是_______________,该变化称为______反应。
(3)沾有水的铁制器皿在高温火焰上会发黑,该反应的化学方程式是__________________。
(4)家庭中常用“84”消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。
“消毒液”与“洁厕灵”同时使用会产生有毒的氯气,写出该反应的离子方程式:____________________________________________。
(5)纯碱(Na2CO3)、小苏打(NaHCO3)广泛应用在食品加工。苏打饼干原料中含有小苏打,在烘焙受热过程中,小苏打发生分解反应,该反应的化学方程式是_____________________________________;苏打饼干可以适当缓解人体胃酸(主要成分盐酸)过多症状,该反应的离子方程式是__________________________________________。
(6)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.5 mol/L碳酸钠溶液和100 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则关于盐酸的浓度可能是( )
A.0.25 mol/LB.0.5 mol/LC.0.75 mol/LD.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g),设起始
CO(g)+3H2(g),设起始![]() =Z,在恒压下,平衡时
=Z,在恒压下,平衡时![]() (CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A. 该反应的焓变ΔH>0
B. 图中Z的大小为a>3>b
C. 图中X点对应的平衡混合物中![]() =3
=3
D. 温度不变时,图中X点对应的平衡在加压后![]() (CH4)减小
(CH4)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
B.NH4HCO3溶于过量的浓KOH溶液中并加热:NH4++HCO3-+2OH-![]() CO32-+NH3↑+2H2O
CO32-+NH3↑+2H2O
C.NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-=BaCO3↓+2H2O+CO32-
D.醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明BF3分子中四个原子在同一平面的理由是
A. 任意两个键的夹角为120°B. B―F键是非极性共价键
C. 三个B―F键的键能相同D. 三个B―F键的键长相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一固定容积的密闭容器中,充入2 mol A和1 mol B发生如下反应:2A(g)+B(g) ![]() xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
xC(g),达到平衡后,C的体积分数为w%;若维持容器体积和温度不变,以0.6 mol A、0.3 mol B和1.4 mol C为起始物质,达到平衡后,C的体积分数也为w%,则x的值为
A.5 B.4 C.3 D.1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL浓硫酸和铜片加热后反应,铜片完全溶解后测得产生4.48L(标况下)气体,把反应后的溶液稀释至1L,取20mL溶液加入足量BaCl2溶液产生3.262g沉淀,求原硫酸溶液的物质的量浓度是多少______?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com