
| A、3d94s2 |
| B、3d54s1 |
| C、3d64s2 |
| D、3d14s2 |


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案科目:高中化学 来源: 题型:
| A、正极和负极可以是两种不同的金属 |
| B、原电池是把化学能转化成电能的装置 |
| C、原电池工作时,电解质溶液中阳离子向负极移动,阴离子向正极移动 |
| D、锌、铜和盐酸构成的原电池工作时,锌片有6.5g溶解,正极上就有0.2g氢气生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氡气在标准状况下密度约是9.91 g?L-1 |
| B、氡气化学性质较活泼,因此对人体有害 |
| C、“锕射气”是氡的同位素 |
| D、氡原子核外有7个电子层,最外层有8个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水体污染 | B、白色污染 |
| C、酸雨产生 | D、农药、化肥污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①② | B、②③ | C、②④ | D、①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molO2中含有原子数为2NA个 |
| B、18gH2O中含有原子数为3NA个 |
| C、常温常压下,22.4L H2O中含有的分子数为NA个 |
| D、1L1mol/L Na2SO4溶液中Na+离子数为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.050 | 0.025 | 0.025 |
| 30 | 0.050 | 0.025 | 0.025 |
| 40 | 0.036 | 0.032 | 0.010 |
| 50 | 0.036 | 0.032 | 0.010 |
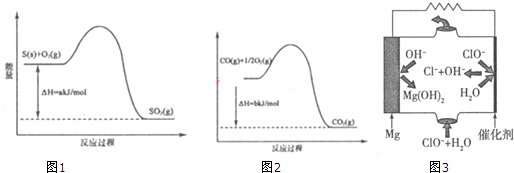
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com