
【题目】甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是( )
A.甲醇、甲醛分子间都可以形成氢键
B.甲醇分子内C原子C原子采取sp2杂化,O原子采取sp杂化
C.甲醛为极性分子,分子中两个C﹣H键夹角小于120°
D.甲醇分子内的O﹣C﹣H键角大于甲醛分子内的O﹣C﹣H键角
【答案】C
【解析】解:A.甲醇分子间存在着氢键,甲醛分子中O原子与水分子中H原子之间可以形成氢键,甲醛分子中,H原子与C原子相连,碳元素的电负性相对较小,甲醛分子间不能形成氢键,故A错误;
B.甲醇(CH3OH),分子内C原子价层电子对数=4+ ![]() =4,采取sp3杂化,O原子价层电子对数=2+
=4,采取sp3杂化,O原子价层电子对数=2+ ![]() =4,采取sp3杂化,故B错误;
=4,采取sp3杂化,故B错误;
C.甲醛分子是平面三角形,碳原子位于三角形内部,结构不对称,所以极性分子,甲醛中C是sp2杂化,C﹣H与C﹣H键夹角理论上是120度,但由于有羰基氧的孤对电子的排斥,实际键角应该略小于120度,故C正确;
D.甲醇分子内C原子的杂化方式为sp3杂化,所以O﹣C﹣H键角约为109°28′,甲醛分子内的C原子的杂化方式为sp2杂化,O﹣C﹣H键角略小于120度,所以甲醇分子内的O﹣C﹣H键角小于甲醛分子内的O﹣C﹣H键角,故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行分析:往该溶液逐滴滴加某浓度NaOH溶液,所加NaOH溶液体积(mL)与产生沉淀的物质的量(mol)的关系如下图所示:下列说法错误的是( ) 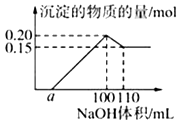
A.该未知溶液中至少含有3种阳离子
B.滴加的NaOH溶液的物质的量浓度为5molL﹣1
C.若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
D.若溶液中仅有两种金属阳离子,且另一种离子为二价阳离子,则a=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常见无机物A、B、C、D存在如图转化关系: 
(1)若D是氯碱工业的主要产品,B有两性氢氧化物,则反应②的离子方程式是:
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为
(3)若A为常见挥发性强酸,D是生产生活中用量最大用途最广的金属单质,则B的化学式可能是 , 写出反应②的离子方程式为 .
(4)若A、C、D都是常见气体,C是形成酸雨的主要气体,则反应③的化学方程式 .
(5)若A、B、C的水溶液均显碱性,焰色反应均为黄色,D为CO2 , 用离子方程式解释B溶液
显碱性的原因(用离子方程式表示) , 举出C的一种用途 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设想利用①3FeCl2+4H2O ![]() Fe3O4+6HCl+H2②Fe3O4+
Fe3O4+6HCl+H2②Fe3O4+ ![]() Cl2+6HCl
Cl2+6HCl ![]() 3FeCl3+3H2O+
3FeCl3+3H2O+ ![]() O2 ③3FeCl3
O2 ③3FeCl3 ![]() 3FeCl2+
3FeCl2+ ![]() Cl2 这三个反应的联合与循环,主要用来生产能解决环境和能源问题的某种气体,该气体是( )
Cl2 这三个反应的联合与循环,主要用来生产能解决环境和能源问题的某种气体,该气体是( )
A.O2
B.Cl2
C.HCl
D.H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成题目:
(1)质量之比为7:6的两种气体CO和NO,分子数之比为;氧原子数之比为;相同条件下的体积之比为 .
(2)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mgmol﹣1 . 若阿伏加德罗常数用NA表示,则:①该气体的物质的量为mol.
②该气体所含原子总数为个.
③该气体在标准状况下的体积为L.
④该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
⑤该气体溶于水后形成VL溶液,其溶液的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是蓝色晶体MxFey(CN)6中阴离子的最小结构单元(图中是该晶体晶胞的八分之一)下列说法正确的是( ) 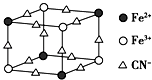
A.该晶体属于离子晶体,M呈+2价
B.该晶体属于分子晶体,化学式为MFe2(CN)6
C.该晶体中与每个Fe3+距离相等且最近的CN﹣为12个
D.该晶体的一个晶胞中含有的M+的个数为4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100molL﹣1 NaOH溶液分别滴定20.00mL 0.100molL﹣1的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是( ) 
A.Ⅱ表示的是滴定醋酸的曲线
B.pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
C.V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
D.V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com