
【题目】根据所学知识,完成题目:
(1)质量之比为7:6的两种气体CO和NO,分子数之比为;氧原子数之比为;相同条件下的体积之比为 .
(2)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mgmol﹣1 . 若阿伏加德罗常数用NA表示,则:①该气体的物质的量为mol.
②该气体所含原子总数为个.
③该气体在标准状况下的体积为L.
④该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为 .
⑤该气体溶于水后形成VL溶液,其溶液的物质的量浓度为molL﹣1 .
【答案】
(1)5:4
(2)![]() ;
;![]() ;
;![]() ;
;![]() ;
;![]()
【解析】解:质量比为7:6的三种气体CO、NO物质的量之比为 ![]() :
: ![]() =5:4,故分子数目之比为5:4:4,含有氧原子数目之比为5×1:4×1=5:4,相同条件下,气体体积之比等于其物质的量之比,则体积之比为5:4,所以答案是:5:4;5:4;5:4;(1)mg该气体的物质的量为:n=
=5:4,故分子数目之比为5:4:4,含有氧原子数目之比为5×1:4×1=5:4,相同条件下,气体体积之比等于其物质的量之比,则体积之比为5:4,所以答案是:5:4;5:4;5:4;(1)mg该气体的物质的量为:n= ![]() mol,所以答案是:
mol,所以答案是: ![]() ;(2)含有原子的物质的量为=
;(2)含有原子的物质的量为= ![]() mol×2=
mol×2= ![]() mol,该气体所含原子总数为:N=
mol,该气体所含原子总数为:N= ![]() mol×NA=
mol×NA= ![]() ,所以答案是:
,所以答案是: ![]() ;(3)mg该气体在标准状况下的体积为:V=n×22.4L/mol=22.4L/mol×
;(3)mg该气体在标准状况下的体积为:V=n×22.4L/mol=22.4L/mol× ![]() mol=
mol= ![]() L,所以答案是:
L,所以答案是: ![]() ;(4)该气体溶于1L水中(不考虑反应),1L水的质量约为1000g,则该溶液中溶质的质量分数为:ω=
;(4)该气体溶于1L水中(不考虑反应),1L水的质量约为1000g,则该溶液中溶质的质量分数为:ω= ![]() ×100%=
×100%= ![]() %,所以答案是:
%,所以答案是: ![]() ;(5)该气体溶于水后形成V L溶液,其溶液中溶质的物质的量浓度为:c=
;(5)该气体溶于水后形成V L溶液,其溶液中溶质的物质的量浓度为:c= ![]() =
= ![]() mol/L=
mol/L= ![]() mol/L,所以答案是:
mol/L,所以答案是: ![]() .
.


科目:高中化学 来源: 题型:
【题目】甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.实验室制取时,将工业用氢氧化钙(含铜离子等杂质)和甲醛依次加入到质量分数为30﹣70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是 .
(2)反应温度最好控制在30﹣70℃之间,温度不易过高,其主要原因是 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 .
(4)实验时需强力搅拌45min,其目的是;结束后需调节溶液的pH 7~8,其目的是 . 最后经结晶分离、干燥得产品.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是( )
A.铁与盐酸的反应:2Fe+6H+=2Fe3++3H2↑
B.石灰石与稀盐酸反应制备二氧化碳:CO ![]() +2H+=H2O+CO2↑
+2H+=H2O+CO2↑
C.向氢氧化铜中滴加硫酸溶液:H++OH﹣=H2O
D.硫酸铜溶液和氢氧化钡溶液混合:Cu2++SO ![]() +Ba2++2OH﹣=Cu(OH)2↓+BaSO4↓
+Ba2++2OH﹣=Cu(OH)2↓+BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中,Na+浓度最大的是
A.0.8L0.4mol/L的NaOH溶液B.0.2L0.15mol/L的Na3PO4溶液
C.1L0.3mol/L的NaCl溶液D.4L0.5mol/L的NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a气体通入b溶液中,实验现象描述正确的组合是( )
a气体 | b溶液 | 预测的现象 | |
① | CO2 | BaCl2溶液 | 白色沉淀析出 |
② | SO2 | Ba(NO3)2 溶液 | 白色沉淀析出 |
③ | Br2 | AgNO3溶液 | 淡黄色沉淀析出 |
④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
A.①②③
B.②③④
C.①②④
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A、B、C、D为中学化学常见单质,B为黄绿色气体,C为无色气体,在一定条件下转化关系如图(部分生成物略去);其中F为淡黄色化合物,H为红褐色沉淀c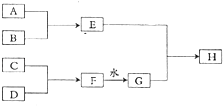
回答下列问题:
(1)C的化学式
(2)F→G反应的化学方程式
(3)向E溶液中通入一定量虽的SO2气体,溶液由黄色变为浅绿色.①浅绿色溶液中一定大量存在的离子有H+、Cl﹣和 .
②某同学认为反应后的溶液中可能存在H2SO3 , 应选择以下试剂(填写序号)加以检验.
A.稀硫酸 B.NaOH溶液C.KSCN溶液D.品红溶液
(4)某温度下,将B(设B的化学式为X2)通入NaOH溶液中,反应得到NaX、NaXO、NaXO3的混合液,经测定XO﹣与XO ![]() 的浓度之比为5:1,则X2与NaOH溶液反应时被还原的X元素与被氧化的X元素的物质的量之比为
的浓度之比为5:1,则X2与NaOH溶液反应时被还原的X元素与被氧化的X元素的物质的量之比为
(5)少量D在实验室中的保存方法是
(6)B的氢化物的水溶液不与Cu反应.若再加入H2O2后,则可使铜顺利溶解.该反应的化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种常见元素的性质或结构信息如下表.试根据信息回答有关问题.
元素 | A | B | C | D |
性质 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx , 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)A元素与其同周期相邻两种元素原子的第一电离能由大到小的顺序为(用元素符号表示);
(2)B元素的低价氧化物分子中心原子的杂化方式为 , B元素与D元素形成分子空间构型为;
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点(填“高”或“低”),其原因是;
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,观察到的现象为;
(5)C晶体的堆积方式如图所示,设C原子半径为r cm,阿伏伽德罗常数用NA表示,则晶胞中C原子的配位数为 , C晶体的密度为gcm﹣3(要求写表达式,可以不化简).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释实验现象的方程式不正确的是( )
A.向盛有少量Mg(OH)2沉淀的试管中滴加适量NH4Cl溶液,沉淀溶解:Mg(OH)2+2NH4+═2NH3?H2O+Mg2+
B.SO2通入澄清石灰水中,产生白色沉淀:SO2+Ca2++2OH﹣═CaSO4↓+H2O
C.向Ca(HCO3)2溶液中加入过量NaOH溶液,有白色沉淀生成:Ca2++2 HCO![]() +2 OH﹣═CaCO3↓+CO
+2 OH﹣═CaCO3↓+CO![]() +2H2O
+2H2O
D.长期过量服用阿司匹林出现水杨酸( ![]() )反应,可静脉注滴NaHCO3溶液:
)反应,可静脉注滴NaHCO3溶液: 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Fe和Cu的质量比为7:8的混和粉末加入到200mL 4mol/L稀硝酸中充分反应(假定还原产物只有NO),则使HNO3完全反应的金属粉末的最小质量为( )
A.12.0g
B.12.8g
C.14.4g
D.15.6g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com