
����Ŀ������ƹ㷺����ʳƷ��������ʯ�͵ȹ�ҵ�����ϣ�300��400�����ҷֽ⣮ʵ������ȡ�ķ���֮һ�ǣ�Ca��OH��2+2HCHO+H2O2=Ca��HCOO��2+2H2O+H2����ʵ������ȡʱ������ҵ���������ƣ���ͭ���ӵ����ʣ��ͼ�ȩ���μ��뵽��������Ϊ30��70%�Ĺ���������Һ�У�Ͷ�����ʵ���֮������Ϊ1��2��1.2�������տɵõ���������98%�������ؽ����������͵����ʲ�Ʒ��
��1��������������������Զ࣬��Ŀ���� ��
��2����Ӧ�¶���ÿ�����30��70��֮�䣬�¶Ȳ����ߣ�����Ҫԭ���� ��
��3���Ʊ�ʱ�ڻ����Һ��Ҫ���������������Ƽ�ȩ��������Ӧ�⣬��Ҫ����������Na2S��Һ�������Ƶ�Ŀ���� ��
��4��ʵ��ʱ��ǿ������45min����Ŀ�������������������Һ��pH 7��8����Ŀ���� �� ��ᾧ���롢����ò�Ʒ��
���𰸡�
��1��ʹ��ȩ������������ȩ�������ʺͲ�Ʒ����
��2����ֹH2O2�ֽ�ͼ�ȩ�ӷ�
��3����ȥ�ؽ������ӣ�ʹ�ؽ��������γ����������ȥ��
��4��ʹ��Ӧ���ֽӴ�����߲��ʣ���ֹ�����ˮ�⣨���ȥ���ᣩ
���������⣺��1��ʵ������ȡ����Ʒ�Ӧԭ��Ϊ��Ca��OH��2+2HCHO+H2O2=Ca��HCOO��2+2H2O+H2������������Ϊ��Ӧ���ѧ��Ӧ��һ�ַ�Ӧ�����Ŀ���Ǵٽ�������Ӧ���ַ�Ӧ�����ת���ʣ���ӹ����Ĺ���������ʹ��ȩ������������ȩ�������ʺͲ�Ʒ���ȣ����Դ��ǣ�ʹ��ȩ������������ȩ�������ʺͲ�Ʒ���ȣ���2���������������ֽ⣺2H2O2 ![]() 2H2O+O2�����¶Ƚϸ�ʱ��˫��ˮ�ֽ⣬��ȩ�е�ֻ�Щ�19.5�棬�ӷ�����Ӧ�¶���ÿ�����30��70��֮�䣬�¶Ȳ����ߣ��ܷ�ֹH2O2�ֽ�ͼ�ȩ�ӷ������Դ��ǣ���ֹH2O2�ֽ�ͼ�ȩ�ӷ�����3���Ʊ�ʱ�ڻ����Һ��Ҫ���������������Ƽ�ȩ��������Ӧ�⣬��Ҫ����������Na2S��Һ���������ؽ������ӽ�������������������ˮ�����Գ�ȥ�ؽ������ӣ����Դ��ǣ���ȥ�ؽ������ӣ�ʹ�ؽ��������γ����������ȥ������4��������ʹʹ��Ӧ���ֽӴ���ʹ�䷴Ӧ��ȫ����߲��ʣ����������Ϊ��������ӣ�������ˮ���������ԣ�������ҺpH 7��8����ҺΪ�����������Ƽ����ˮ�⣬�������������Һ��pH 7��8���������ԣ��ܳ�ȥ���ᣬ���Դ��ǣ�ʹ��Ӧ���ֽӴ�����߲��ʣ���ֹ�����ˮ�⣨���ȥ���ᣩ��
2H2O+O2�����¶Ƚϸ�ʱ��˫��ˮ�ֽ⣬��ȩ�е�ֻ�Щ�19.5�棬�ӷ�����Ӧ�¶���ÿ�����30��70��֮�䣬�¶Ȳ����ߣ��ܷ�ֹH2O2�ֽ�ͼ�ȩ�ӷ������Դ��ǣ���ֹH2O2�ֽ�ͼ�ȩ�ӷ�����3���Ʊ�ʱ�ڻ����Һ��Ҫ���������������Ƽ�ȩ��������Ӧ�⣬��Ҫ����������Na2S��Һ���������ؽ������ӽ�������������������ˮ�����Գ�ȥ�ؽ������ӣ����Դ��ǣ���ȥ�ؽ������ӣ�ʹ�ؽ��������γ����������ȥ������4��������ʹʹ��Ӧ���ֽӴ���ʹ�䷴Ӧ��ȫ����߲��ʣ����������Ϊ��������ӣ�������ˮ���������ԣ�������ҺpH 7��8����ҺΪ�����������Ƽ����ˮ�⣬�������������Һ��pH 7��8���������ԣ��ܳ�ȥ���ᣬ���Դ��ǣ�ʹ��Ӧ���ֽӴ�����߲��ʣ���ֹ�����ˮ�⣨���ȥ���ᣩ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ������������ˮ������B. ����������������������������κ���
C. ��������趼�ǰ뵼�����D. ��ҵ���Զ�������Ϊԭ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���� ![]() ���γ�HmX���⻯��� a g HmX ���У� ��
���γ�HmX���⻯��� a g HmX ���У� ��
A.![]() mol����
mol����
B.![]() mol����
mol����
C.![]() mol����
mol����
D.![]() mmol HmX
mmol HmX
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ�ģ� ��
A. �Ͻ���۵������ɳɷֽ������۵��
B. SO2����Ư������ʹ��ɫʯ����Һ�ȱ�����ɫ
C. ��Fe��Al��������Ũ���ᷴӦ���ʲ�����Fe��Al������ʢ��Ũ����
D. Һ���ӷ����ܶȴ���ˮ������ʱ����ˮ�ⷨ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Zn-MnO2�ɵ��Ӧ�ù㷺����������Һ��ZnCl2-NH4Cl�����Һ��
��1���õ�صĸ���������________����ع���ʱ����������________��������������������������
��2����ZnCl2-NH4Cl�����Һ�к�������Cu2+�������ij�缫�ĸ�ʴ������Ҫԭ����________������ȥCu2+�����ѡ�������Լ��е�________������ţ���
a��NaOH b��Zn c��Fe d��NH3��H2O
��3��MnO2����������֮һ����ʯīΪ�缫������ữ��MnSO4��Һ�������ĵ缫��Ӧʽ��________��������·��ͨ��2 mol���ӣ�MnO2�����۲���Ϊ________��
��4���ü�ӵ绯ѧ����ȥNO�Ĺ��̣�����ͼ��ʾ��

��֪���ص�����������Һ��pH��4~7֮�䣬д�������ĵ缫��Ӧʽ��_____________�������ӷ���ʽ��ʾ���ճ��г�ȥNO��ԭ����____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���ù�ҵ̼��ƣ���Ҫ�ɷ�ΪCaCO3������Ϊ��Al2O3��FeCO3�� Ϊԭ�ϣ����Ʊ������Σ������������Һ�����ȡ����ƣ������ͼ�������ʵ��ܽ������������ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ1.0molL��1���㣩�����ṩ���Լ��У�a�������ƣ�b.5molL��1���ᣬc.5molL��1���ᣬd.5molL��1���ᣬe.3%H2O2��Һ��f������ʯ��ˮ��
�������� | ��ʼ������pH | ������ȫ��pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
�벹��������̼����Ʊ�����Ƶ�ʵ�鲽��
����1����ȡ13.6g����������Լ20mLˮ�������Һ���ã�����ȡ��ϸ��̼�����Ʒ10g���ã�
����2�� ��
����3�� ��
����4�����˺���Һ���������Һ��ϣ�������ҺpH 7��8����ֽ��裬������Һ������ϴ�Ӹ���ü���ƾ��壮
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ni��NiO��Ni3C���é�Al2O3��ɵĴ������棬��ʵ��H2O��CO2��CH4�ϳ��Ҵ���
��1������˵����ȷ������ѡ����ţ���
A.��һ�����ܣ�̼ԭ�Ӵ�����ԭ��
B.NO+����ʽΪ ![]()
C.̼������CH3����������
D.�����ѵķе���Ҵ���
��2��Ni2+��̬�����Ų�ʽ ��
��3��NiO������ͼ1��ʾ��ÿ����������ÿ��Ni2+��������������O2������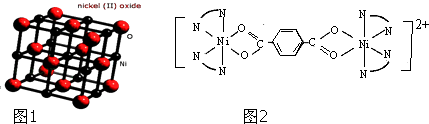
��4���Ա������ᣨ 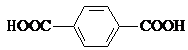 ����4��4�䩁�����
����4��4�䩁����� 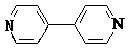 ���ɼ�Ϊ
���ɼ�Ϊ ![]() ������Ni2+���γɶ�����������[Ni2��TPHA����bpy��4]��ClO4��2�����ӵĽṹ��ͼ2��TPHA���Ա������������� bpy��4��4����� �����������λԭ���ǣ����Ա��������е�̼���ӻ���ʽΪ �� 1mol 4��4�䩁����ऺ��ЦҼ�Ϊ ��
������Ni2+���γɶ�����������[Ni2��TPHA����bpy��4]��ClO4��2�����ӵĽṹ��ͼ2��TPHA���Ա������������� bpy��4��4����� �����������λԭ���ǣ����Ա��������е�̼���ӻ���ʽΪ �� 1mol 4��4�䩁����ऺ��ЦҼ�Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ���ѽ������ϩ��ȡHOCH2COOH����Ҫ�����ķ�Ӧ������(����)
A.����������������ȡ������ˮ��
B.�ӳɡ���ˮ�⡪��������������
C.��������ȡ��������������ˮ��
D.ˮ�⡪������������������ȡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ֪ʶ�������Ŀ��
��1������֮��Ϊ7��6����������CO��NO��������֮��Ϊ����ԭ����֮��Ϊ����ͬ�����µ����֮��Ϊ ��
��2������mgij���壬����˫ԭ�ӷ��ӹ��ɣ�����Ħ������ΪMgmol��1 �� �������ӵ�������NA��ʾ���ٸ���������ʵ���Ϊmol��
�ڸ���������ԭ������Ϊ����
�۸������ڱ�״���µ����ΪL��
�ܸ���������1Lˮ�У������Ƿ�Ӧ��������Һ�����ʵ���������Ϊ ��
�ݸ���������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��ΪmolL��1 ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com