
【题目】下列说法正确的是
A. 二氧化硅溶于水显酸性B. 二氧化硅是酸性氧化物,它不溶于任何酸
C. 二氧化硅和硅都是半导体材料D. 工业上以二氧化硅为原料生产硅
科目:高中化学 来源: 题型:
【题目】已知:
2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJmol﹣1;
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣890kJmol﹣1 .
现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695kJ,则原混合气体中H2与CH4的物质的量之比是( )
A.1:1
B.1:3
C.1:4
D.2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有200mLMgCl2和AlCl3的混合溶液,其中c(Mg2+)为0.2mol/L,c(Cl﹣)为1.3mol/L,要使Mg2+与Al3+完全分离,至少需加4mol/L的NaOH溶液的体积为( )
A.40mL
B.72mL
C.80mL
D.128mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A~E间的转化关系如下图所示。A是石油裂解气的主要成分,其产量通常用来衡量一个国家的石油化工水平。E为生活中常用的有机高分子化合物。

回答下列问题:
(1)A的名称是__________;将A通入溴的四氯化碳溶液中,现象为________。
(2)写出E的结构简式:__________________________。
(3)④的反应类型为______________,写出其化学方程式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学通过查阅资料得知,可利用Na2SO3粉末与70%硫酸溶液在加热条件下反应来快速制取SO2。该同学设计了下图所示装置制取SO2并验证其性质。
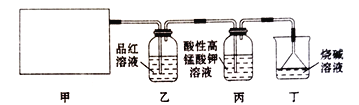
回答下列问题:
(1)根据资料中的相关信息,甲装置应选择下列装置中的____________(填序号)。

(2)实验过程中,丙装置中酸性高锰酸钾溶液紫红色褪去,说明SO2具有_________性,证明SO2具有漂白性的现象为___________________________________。
(3)丁装置的作用是____________,写出其中发生主要反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年世界环境日主题是“人与自然,相联相生” 。下列做法应该提倡的是( )
A. 将工业废液直接排入海洋以减少河道污染 B. 推广使用高效、低毒农药,减轻水体污染
C. 将废旧电池集中深埋,可防止重金属污染 D. 增高燃煤锅炉烟囱,将废气直接排到高空
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用双线桥分析下列氧化还原反应中化合价变化、得失电子情况,并指出氧化剂和还原剂是什么.
(1)H2+CuO═Cu+H2O;上面反应中,氧化剂是:还原剂是: , “双线桥”表示电子转移方向及数目为
(2)C+2CuO═2Cu+CO2↑;该反应中氧化剂是:还原剂是: . 双线桥法为: ,
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.实验室制取时,将工业用氢氧化钙(含铜离子等杂质)和甲醛依次加入到质量分数为30﹣70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是 .
(2)反应温度最好控制在30﹣70℃之间,温度不易过高,其主要原因是 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 .
(4)实验时需强力搅拌45min,其目的是;结束后需调节溶液的pH 7~8,其目的是 . 最后经结晶分离、干燥得产品.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com