
【题目】Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是________。欲除去Cu2+,最好选用下列试剂中的________(填代号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(3)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阴极的电极反应式是________。若电解电路中通过2 mol电子,MnO2的理论产量为________。
(4)用间接电化学法除去NO的过程,如下图所示:

已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:_____________。用离子方程式表示吸收池中除去NO的原理:____________________________________。
【答案】 Zn(或锌) 正极 Zn与Cu2+反应生成Cu,Zn与Cu构成原电池,加快反应速率 b 2H++2e-=H2↑ 87g 2HSO3- + 2e- + 2H+ === S2O42- + 2H2O 2NO + 2S2O42- +2H2O === N2 + 4HSO3-
【解析】本题主要考查原电池原理。
(1)该电池的负极材料是锌。电池工作时,电子由负极流向正极。
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是Zn与Cu2+反应生成Cu,Zn与Cu构成原电池,加快反应速率。欲除去Cu2+,最好选用下列试剂中的Zn,可以防止产生杂质离子。
(3)阴极的电极反应式是2H++2e-=H2↑。若电解电路中通过2mol电子,MnSO4~MnO2~2e-,MnO2的理论产量为1mol即87g。
(4)阴极室溶液呈酸性,阴极的电极反应式:2HSO3-+2e-+2H+=S2O42-+2H2O。用离子方程式表示吸收池中除去NO的原理:2NO+2S2O42-+2H2O=N2+4HSO3-。


 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案科目:高中化学 来源: 题型:
【题目】某同学通过查阅资料得知,可利用Na2SO3粉末与70%硫酸溶液在加热条件下反应来快速制取SO2。该同学设计了下图所示装置制取SO2并验证其性质。
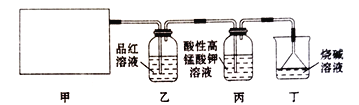
回答下列问题:
(1)根据资料中的相关信息,甲装置应选择下列装置中的____________(填序号)。

(2)实验过程中,丙装置中酸性高锰酸钾溶液紫红色褪去,说明SO2具有_________性,证明SO2具有漂白性的现象为___________________________________。
(3)丁装置的作用是____________,写出其中发生主要反应的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是( )

A. 一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X + 3Y![]() Z
Z
B. 图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂
C. 常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示。当7<pH<13 时,溶液中c(Na+)>c(CH3COO->c(OH-)>c(H+)
D. 用硝酸银溶液滴定等浓度的A-、B-、C-的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是C-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,能达到实验目的是( )
A.![]() 从Mg(OH)2悬浊液中分离出Mg(OH)2
从Mg(OH)2悬浊液中分离出Mg(OH)2
B.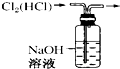 除去Cl2中的HCl
除去Cl2中的HCl
C.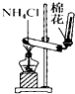 实验室制氨气
实验室制氨气
D. 排水法收集NO
排水法收集NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑.实验室制取时,将工业用氢氧化钙(含铜离子等杂质)和甲醛依次加入到质量分数为30﹣70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是 .
(2)反应温度最好控制在30﹣70℃之间,温度不易过高,其主要原因是 .
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是 .
(4)实验时需强力搅拌45min,其目的是;结束后需调节溶液的pH 7~8,其目的是 . 最后经结晶分离、干燥得产品.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是( )
A. SO2具有氧化性,可用于漂白纸浆
B. 明矾易溶于水,可用作净水剂
C. 浓硫酸具有脱水性,可用于干燥氢气
D. MgO、Al2O3熔点高,可用于制作耐火材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面各物质之间的转化关系,回答问题: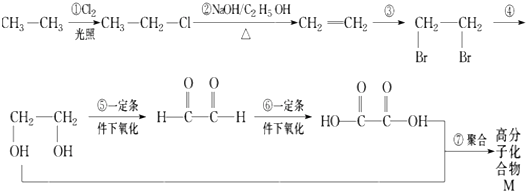
(1)属于取代反应的是 .
(2)属于加成反应的是 .
(3)写出反应③、④的化学方程式(有机物用结构简式表示,注明反应条件,下同)
a.反应③ .
b.反应④ .
c.写出 ![]() 和新制氢氧化铜悬浊液(NaOH碱性环境)反应的化学方程式 .
和新制氢氧化铜悬浊液(NaOH碱性环境)反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将a气体通入b溶液中,实验现象描述正确的组合是( )
a气体 | b溶液 | 预测的现象 | |
① | CO2 | BaCl2溶液 | 白色沉淀析出 |
② | SO2 | Ba(NO3)2 溶液 | 白色沉淀析出 |
③ | Br2 | AgNO3溶液 | 淡黄色沉淀析出 |
④ | NH3 | AlCl3溶液 | 白色沉淀析出 |
A.①②③
B.②③④
C.①②④
D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com