
反应I2+I- I3-达到平衡时c(I3-)与温度的关系如图所示。
I3-达到平衡时c(I3-)与温度的关系如图所示。
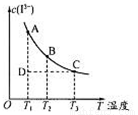
下列说法正确的是
A.图中反应进行到状态D时,一定有v逆>v正
B.A点和B点的化学平衡常数相同
C.对B点溶液升高温度时,该反应△v正>△v逆
D.增大KI溶液浓度有利于I2的溶解
D
【解析】
试题分析:A、B、C三点都是处于平衡曲线上,处于平衡状态。A .图中反应进行到状态D时,这时对应的温度是T1,A点才是平衡状态。D是不平衡状态。从D→A慢慢建立平衡过程中,c(I3-)增大,说明反应要向又进行,所以一定有v正>v逆。A错误。B.A点和B点的化学平衡常数不相同,因为T1、 T2两个不同温度。C.从A→C过程中,温度逐渐升高,c(I3-)逐渐减小,平衡向左移动,说明逆反应吸热,正反应放热。所以对B点溶液升高温度时,平衡向逆反应方向移动,该反应△v逆>△v正。D.增大KI溶液浓度,平衡像正反应方向移动,显然有利于I2的溶解
考点:溶解平衡的考查及改变条件的影响


科目:高中化学 来源: 题型:
| ||
| ||
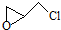 ,则该有机物核磁共振氢谱有
,则该有机物核磁共振氢谱有
| I | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
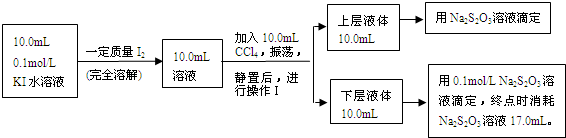
| c[I2(CCl4)] |
| c[I2(H2O)] |
| 0.049mol/L |
| 0.001mol/L×0.051mol/L |
| 0.049mol/L |
| 0.001mol/L×0.051mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
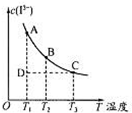 反应I2+I-?I3-达到平衡时c(I3-)与温度的关系如图所示.下列说法正确的是( )
反应I2+I-?I3-达到平衡时c(I3-)与温度的关系如图所示.下列说法正确的是( )| A、图中反应进行到状态D时,一定有v逆>v正 | B、A点和B点的化学平衡常数相同 | C、对B点溶液升高温度时,该反应△v正>△v逆 | D、增大KI溶液浓度有利于I2的溶解 |
查看答案和解析>>
科目:高中化学 来源:0110 模拟题 题型:实验题
 I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
I3-。通过测平衡体系中c(I2)、c(I-)和c(I3-),就可求得该反应的平衡常数。
 是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题:
是一个常数(用Kd表示,称为分配系数),且室温条件下Kd=85。回答下列问题: I3-的平衡常数K=__________(用具体数据列出计算式即可)。
I3-的平衡常数K=__________(用具体数据列出计算式即可)。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com