
将一定量的氨基甲酸铵固体置于某容积恒定的真空容器中,发生反应:H2NCOONH4(s)⇌2NH3(g)+CO2(g)在不同温度下,该反应平衡状态部分数据见表.下列说法正确的是( )
| 温度 | 平衡浓度/(mol L﹣1) | |
| c(NH3) | c(CO2) | |
| T1 | 0.1 | |
| T2 | 0.1 |
|
| A. | 若T2>T1,则该反应的△H<0 |
|
| B. | 向容器中充入N2,H2NCOONH4质量增加 |
|
| C. | NH3体积分数不变时,说明该反应达到平衡 |
|
| D. | T1、T2时,H2NCOONH4转化的△n(T2)=2△n(T1) |
| 化学平衡建立的过程.. | |
| 专题: | 化学平衡专题. |
| 分析: | A.根据在不同温度下平衡浓度c(NH3)的大小确定平衡移动的方向,然后根据温度对化学平衡的影响; B.根据向容器中充入N2,没有引起各物质浓度的变化; C.反应混合气体只有氨气与二氧化碳,二者物质的量之比始终为2:1; D.根据反应的物质的量之比等于化学计量数之比. |
| 解答: | 解:A.T1时c(NH3)=0.1mol L﹣1,T2时c(NH3)=0.2mol L﹣1,若T2>T1,则升高温度平衡正向移动,而升高温度平衡向吸热的方向移动,所以该反应的△H>0,故A错误; B.根据向容器中充入N2,没有引起各物质浓度的变化,速率不变,平衡不移动,故B错误; C.反应混合气体只有氨气与二氧化碳,二者物质的量之比始终为2:1,所以NH3体积分数不变时,不能说明该反应达到平衡,故C错误; D.由A选项得T1时c(NH3)=0.1mol L﹣1,T2时c(NH3)=0.2mol L﹣1,反应的物质的量之比等于化学计量数之比,所以H2NCOONH4转化的△n(T2)=2△n(T1),故D正确; 故选D. |
| 点评: | 本题主要考查了化学平衡的移动,难度不大,需要注意的是当反应物为固体,生成物为气体的混合物时,气体的体积分数不变,不能作为平衡移动的标志. |


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
下列说法中错误的是 ( )
A. 1gO2与1gO3所含的原子数目相等 B.不同分散系其对应分散质的微粒直径不同
C. 标况下1molCCl4所占体积约为22.4L D. NaCl晶体和熔化的NaCl都属于电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
由反应物微粒一步直接实现的化学反应称为基元反应。某化学反应是通过三步基元反应实现的:
①Ce4++Mn2+ → Ce3++Mn3+;②Ce4++Mn3+ → Ce3++Mn4+;③Ti+ + Mn4+ → Ti3+ + Mn2+。
由此可知,该反应的催化剂是
A.Ce3+ B.Ti3+ C.Mn3+ D.Mn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是( )
A.生成物总能量一定低于反应物总能量
B.放热反应的反应速率总是大于吸热反应的反应速率
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=﹣4b kJ•mol﹣1 |
|
| B. | 已知:H2(g)+F2(g)═2HF(g)△H=﹣270 kJ•mol﹣1,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
|
| C. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) |
|
| D. | 已知:①C(s,石墨)+O2(g)═CO2(g)△H=﹣393.5 kJ•mol﹣1,②C(s,金刚石)+O2(g)═CO2(g)△H=﹣395.0 kJ•mol﹣1,则C(s,金刚石)═C(s,石墨)△H=﹣1.5 kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
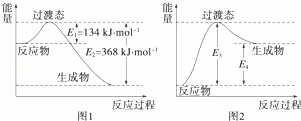
过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态.如图1是1mol NO2与1mol CO恰好反应生成CO2和NO过程中的能量变化示意图.
(1)试写出NO2和CO反应的热化学方程式: NO2(g)+CO(g)═NO(g)+CO2(g)△H=﹣234kJ•mol﹣1 .该反应的活化能是 134 kJ•mol﹣1.
(2)在密闭容器中进行的上述反应是可逆反应,则其逆反应的热化学方程式为 NO(g)+CO2(g)═NO2(g)+CO(g)△H=+234kJ•mol﹣1 ,该反应的活化能为 368 kJ•mol﹣1.
(3)图2是某学生模仿图1画出的NO(g)+CO2(g)═NO2(g)+CO(g)的能量变化示意图.则图中E3= 368 kJ•mol﹣1,E4= 234 kJ•mol﹣1.
查看答案和解析>>
科目:高中化学 来源: 题型:
1体积某气态烃和1体积氯化氢发生加成反应后,最多还能和4体积氯气发生取代反应。由此可以断定原气态烃是(气体体积均在相同条件下测定)
A.CH2=CHCl B.CH3CH=CHCH3
C.CH2=CH2 D.(CH3)2C=C(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
两种化合物A和B只含C、H、O三种元素。若A和B以任意物质的量比混合,完全燃烧后生成CO2的体积都是消耗O2体积的2倍(同温同压下测定),即它们的分子组成符合通式:
(CO)x(H2O)y(x、y为正整数)。已知A和B的相对分子质量分别是a和b,且a>b。
请按要求回答下列问题:
(1)若A、B分子中氢原子数相同,A、B相对分子质量的差值一定是(填一个数字)
的整数倍。
(2)试写出符合此条件且A和B的相对分子质量最小的化合物的分子式:A ,B ;结构简式:A ,B 。
(3)写出与(2)中B相对分子质量相差14,且不属于同类物质的两种分子的结构简式: 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在给定一定物质的量的理想气体,影响其所占体积大小的主要因素是 ( )
A.分子直径的大小 B.分子间距离的大小
C.分子间引力的大小 D.分子数目的多少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com